醫療器械執法中經常查看的“合格證明”,是指什么?
CIO專家-蓯蓉
今年以來,湖北各級市場監管部門聚焦“護航優勢產業、特色經濟、創新創業、營商環境、民生品質”,圍繞“民意最盼、市場主體最憂、市場監管風險和壓力最大”的重點領域、重點市場、重點行業、重點商品和服務,扎實推進2022民生領域案件查辦“鐵拳”行動,嚴厲打擊食品安全違法違規、加油機計量作弊、侵權假冒、“神醫”“神藥”等虛假違法廣告、售賣非法捕撈漁獲物等十一類違法行為,查辦了一批涉及群眾健康安全、性質惡劣的違法案件。7月20日,湖北省市場監管局公布了6個典型案例,一起典型案件如下:
案例1:黃岡市紅安縣市場監管局查處武漢市康本龍醫療器械有限公司銷售無合格證明文件口罩案
2022年4月26日,黃岡市紅安縣市場監管局依法對武漢市康本龍醫療器械有限公司銷售無合格證明文件口罩的違法行為,作出警告、沒收無合格證明文件醫用口罩21810個、罰款3033.684萬元的行政處罰。
醫療器械合格證明是什么?合格證明文件包含哪些?無合格證明或未查驗合格證明文件,監管部門是否可以判定為銷售不合格的醫療器械?
合格證明
《產品質量法》第二十七條第一款規定:“產品或者其包裝上的標識必須真實,并符合下列要求:(一)有產品質量檢驗合格證明”。第三十三條銷售者應當建立并執行進貨檢查驗收制度,驗明產品合格證明和其他標識。由此法規可見生產企業在產品出廠銷售時,需要具備質量檢驗合格證明;銷售者應驗明產品合格證明。
產品合格證是指生產者為表明出廠的產品經質量檢驗合格,附于產品或者產品包裝上的合格證書、合格標簽或者合格印章。
由于目前法律法規尚未對產品的合格證格式進行明確規定,而合格證明是生產廠家自行制作的,因此導致合格證明格式千差萬別、繁簡不同,甚至相同廠家不同時期、不同品種的合格證明格式都不相同;其形式主要有3種:合格證書、檢驗合格印章和檢驗工序編號印章。
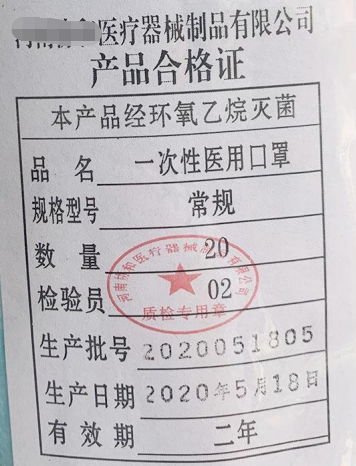

而2014年6月1日修改后的《醫療器械監督管理條例》已經將原條例中的“合格證明”修訂為“合格證明文件”,增加“文件”二字,使合格證明不僅僅是一項資料,而轉變成一系列證明文件。
雖然現行有關醫療器械管理法規對“合格證明文件”的形式和內容尚無明確界定。我們仍可以找到合格證明的蛛絲馬跡。2019年修訂的《藥品管理法實施條例》第七十七條規定:“藥品合格證明和其他標識,是指藥品生產批準證明文件、藥品檢驗報告書、藥品的包裝、標簽和說明書。”從該條規定來看,可將藥品的合格證明理解為藥品生產批準證明文件和藥品檢驗報告書。雖然藥品和醫療器械的監管不同,但也有一定的指導作用。
合格證明文件有哪些?
《醫療器械監督管理條例》(國務院739號令)第三十五條規定“醫療器械注冊人、備案人、受托生產企業應當……嚴格按照經注冊或者備案的產品技術要求組織生產,保證出廠的醫療器械符合強制性標準以及經注冊或者備案的產品技術要求。”由上述法律法規可以看到,合格證明文件已不再被提及,重點強調出廠的醫療器械應符合強制性標準以及經注冊或者備案的產品技術要求。
另外,《醫療器械經營監督管理辦法》(總局53號令)第三十四條“醫療器械注冊人、備案人應當負責產品上市放行,建立產品上市放行規程,明確放行標準、條件,并對醫療器械生產過程記錄和質量檢驗結果進行審核,符合標準和條件的,經授權的放行人員簽字后方可上市。委托生產的,醫療器械注冊人、備案人還應當對受托生產企業的生產放行文件進行審核”。53號令已不再要求生產企業出具合格證明文件,取而代之的是以注冊人、備案人簽發的上市放行文件作為合格證明文件。
雖然最新發布的法律法規已不再提及合格證明文件,但這并不意味著監管部門可以不再要求企業提供合格證明文件。
監督檢查
《醫療器械經營監督管理辦法》(總局54號令)第三十二條“醫療器械經營企業應當建立進貨查驗記錄制度,購進醫療器械時應當查驗供貨企業的資質,以及醫療器械注冊證和備案信息、合格證明文件”。第四十五條“從事醫療器械經營活動的,不得經營未依法注冊或者備案,無合格證明文件以及過期、失效、淘汰的醫療器械”。上述法律法規仍對經營者收集醫療器械合格證明文件作出了要求。
判定醫療器械產品是否合法,首先要看產品是否經注冊或備案,且屬于有效期內生產的產品,然后再看產品是否有合格證明文件。如果產品未經依法注冊或備案,則無需再考慮是否有合格證明文件。最后查看企業是否建立進貨查驗制度,履行查驗義務。需要注意的是,未查驗購進醫療器械的合格證明文件,不等于該產品屬于無合格證明文件的產品。如果產品在出廠前檢驗合格,則屬于有合格證明文件的產品,如果未經檢驗或檢驗不合格,則屬于無合格證明文件的產品。
《醫療器械監督管理條例》的立法目的是為了保證醫療器械的安全、有效,保證人體健康和生命安全;在國家監管部門對此作出明確解釋之前,對“合格證明文件”這一術語的理解應當符合其立法之目的。《條例》中規定的合格證明文件,其含義顯然不僅僅包括出廠合格證明,還應包括符合我國醫療器械標準的其他合格證明文件,也只有這樣,才能實現保證我國境內醫療器械的安全、有效,保證我國人民人體健康和生命安全的立法目的。
如果您有產品技術要求資料審核或供應商審計等需求,點擊下方聯系我們。
相關文件下載、服務及學習課程:
合規文庫:醫療器械產品技術要求編寫指導原則
合規培訓:《醫療器械經營監督管理辦法》看點及新舊法規對比解析(下)
合規服務:醫療器械產品技術要求編寫服務
聯系專家,獲取專家指導意見:e邀專家
























