中國體外診斷試劑注冊備案新手指南(上)
CIO專家-天葵子
根據《醫療器械監督管理條例》、《體外診斷試劑注冊管理辦法》及《醫療器械生產監督管理辦法》等文件,并圍繞“人機料法環”五大方面給新手RA提供體外診斷試劑(以下簡稱“IVD”)注冊備案的精簡指南。
各類IVD向哪個監管部門申請?怎么申請?申請材料有哪些?我給大家整理成一個思維導圖更好地了解,具體的詳情可以看法規文件或者上當地的政務網查看信息。
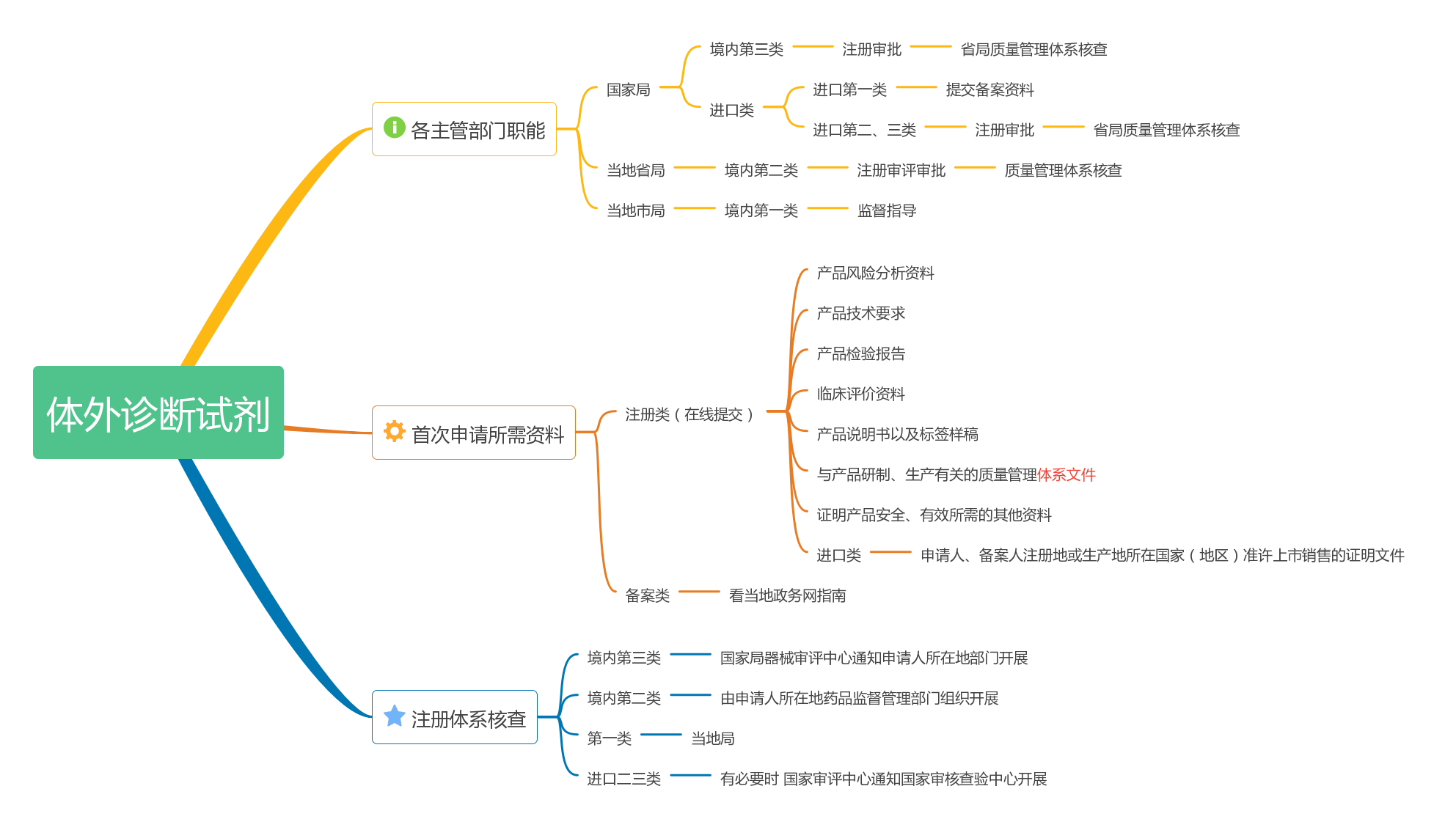
綜述資料準備的難點有以下:
a. 產品綜述
(1)描述產品所采用的技術原理,產品組成,原材料的來源及制備方法,主要生產工藝,檢驗方法,質控品的制備方法及賦值情況,如產品檢測需要進行校準,應描述校準品的制備方法及溯源情況, 而當中精密度,最低檢出限, 分析特異性, 高劑量鉤狀效應都不能忽略。
注:技術原理包括反應原理(如雙抗原夾心法、雜交捕獲法),方法學(如化學發光法、比濁法),測量方法(如終點法、速率法),信號處理方法,數據獲取和解讀方式,分析前處理步驟等。 如果產品涉及測試儀器,儀器的使用,原理,標準也需要提供。
b. 描述產品主要研究結果的總結和評價,包括分析性能評估。
c. 陰 、陽性判斷值或參考區間、穩定性,使用穩定性以及臨床評價等。
d. 描述不同包裝規格之間的差異。
e. 描述產品中使用的生物材料或衍生物(如適用),包括生物學來源(如人、動物、病原體、重組或發酵產物)和組織來源(如血液)。人源性材料須對有關傳染病(HIV、HBV、HCV等)病原體檢測予以說明。其他動物源及微生物來源的材料,應當說明其在產品運輸、使用過程中對使用者和環境是安全的,并提供相關的文件。
f. 包裝描述:有關產品包裝的信息,包括包裝形狀和材料。
g. 研發歷程 :闡述申請注冊產品的研發背景和目的。如有參考的同類產品或前代產品,應當提供同類產品和/或前代產品的信息,并說明選擇其作為研發參考的原因。
h. 與同類和/或前代產品的比較。
i. 境內、外已有同類產品和/或前代產品上市,申請人應提供其產品名稱、生產企業、注冊情況,并列表比較申報產品與同類產品和/或前代產品在技術原理、預期用途、使用方法、性能指標、臨床應用情況等方面的異同。
j. 境內、外尚無同類產品上市,或申報產品改變常規預期用途并具有新的臨床意義,申請人需提供分析物與預期臨床適應證之間關系的文獻資料,包括臨床研究文獻綜述、相關臨床診療指南文件、行業公認的共識性文件等。
k. 預期用途
(1)預期用途:應明確產品用于檢測的分析物和功能(如輔助診斷、鑒別診斷、篩查或監測等),并寫明適用儀器、使用方法(自動/半自動/手工)、檢測類型(定性/定量/半定量)、樣本類型(如血清、血漿、尿液、腦脊液)和/或添加劑(如抗凝劑)、樣本采集及保存裝置等。
(2)臨床適應證:臨床適應證的發生率、易感人群、分析物的詳細介紹及與臨床適應證的關系,相關的臨床或實驗室診斷方法。
(3)適用人群:目標患者/人群的信息,對于適用人群包含亞群、兒童或新生兒的情況,應進行明確。
(4)預期使用者:專業或非專業。
(5)預期使用環境。
* 申報產品預期使用的地點:可能會影響其安全性和有效性的環境條件(如溫度、濕度、海拔)。
l. 申報產品上市歷史 如適用,應當提交申報產品的下列資料:
(1) 上市情況:截至提交注冊申請前,申報產品在各國家或地區的上市批準時間、銷售情況。若申報產品在不同國家或地區上市時有差異(如設計、標簽、技術參數等),應當逐一描述。
(2) 不良事件和召回:如適用,應當以列表形式分別對申報產品上市后發生的不良事件、召回的發生時間以及每一種情況下申請人采取的處理和解決方案,包括主動控制產品風險的措施,向醫療器械不良事件監測技術機構報告的情況,相關部門的調查處理情況等進行描述。同時,應當對上述不良事件、召回進行分析評價,闡明不良事件、召回發生的原因并對其安全性、有效性的影響予以說明。若不良事件、召回數量大,應當根據事件類型總結每個類型涉及的數量。
(3) 銷售、不良事件及召回率:如適用,應當提交申報產品近五年在各國家(地區)銷售數量的總結,按以下方式提供在各國家(地區)的不良事件、召回比率,并進行比率計算關鍵分析。 如:不良事件發生率=不良事件數量÷銷售數量×100%,召回發生率=召回數量÷銷售數量×100%。發生率可以采用每使用患者年或每使用進行計算,申請人應當描述發生率計算方法。如不適用,應當提供相應說明。
m. 其他需說明的內容
(1) 除申報產品外,檢測系統的其他組成部分,包括但不限于:樣本處理用試劑、適用儀器、質控品、校準品、獨立軟件等基本信息,及其在檢測中發揮的作用,必要時應提交相應的說明書。
(2) 對于已獲得批準的檢測系統的其他組成部分,應當提供注冊證編號和國家藥監局官方網站公布的注冊證信息。 如不適用,應當提供相應說明。
以上就是IVD申請流程和綜述資料準備難點,下篇預告:如何解決“人機料法環”五大神獸?給作者更多鼓勵,作者更新越快~
下篇閱讀:中國體外診斷試劑注冊備案新手指南(下)
如果您需要體外診斷試劑注冊/備案,點擊下方聯系我們。
相關文件下載、服務及學習課程:
合規文庫:4.體外診斷試劑注冊申報資料要求及說明
合規培訓:中國醫療器械產業發展報告
合規服務:體外診斷試劑注冊證核發
聯系專家,獲取專家指導意見:e邀專家
























