基本信息
1. 辦理部門:廣東省市場監督管理局
2. 辦理方式:網上辦理
3. 辦理地點:廣州市天河區體育西路57號二樓登記注冊大廳1號至7號窗口
4. 藥監咨詢:020-38835008 CIO咨詢:400-003-0818
受理條件
符合以下全部條件的可以提出申請:
(一)使用的原料已經列入保健食品原料目錄的保健食品;首次進口的屬于補充維生素、礦物質等營養物質的保健食品。
首次進口的屬于補充維生素、礦物質等營養物質的保健食品,其營養物質應當是列入保健食品原料目錄的物質。
(二)備案的產品配方、原輔料名稱及用量、功效、生產工藝等應當符合法律、法規、規章、強制性標準以及保健食品原料目錄技術要求的規定。
辦理流程
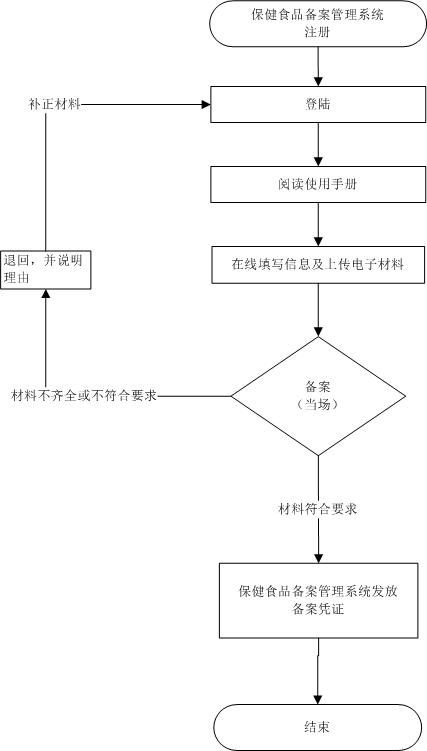
流程文字說明
1.獲取備案系統登錄賬號。國產保健食品備案人應向所在地省、自治區、直轄市市場監督管理部門提出獲取備案管理信息系統登錄賬號的申請,原注冊人產品轉備案的,應當向總局技術審評機構提出申請。
2.產品備案信息填報、提交。備案人獲得備案管理信息系統登錄賬號后,進入系統,認真閱讀《保健食品備案信息系統備案人使用手冊》并按照相關要求逐項填寫備案人及申請備案產品相關信息,逐項打印系統自動生成的附帶條形碼、校驗碼的備案申請表、產品配方、標簽說明書、產品技術要求等,連同其他備案材料,逐頁在文字處加蓋備案人公章(檢驗機構出具的檢驗報告、公證文書、證明文件除外)。備案人將所有備案紙質材料清晰掃描成彩色電子版(PDF格式)上傳至保健食品備案管理信息系統,確認后提交。原注冊人已注冊(或申請注冊)產品轉備案的,進入保健食品備案管理信息系統后,可依據《保健食品原料目錄》及相關備案管理要求,修改和完善原注冊產品相關信息,并注明修改的內容和理由。
3.發放備案號、存檔和公開。備案材料符合要求的,備案管理部門當場備案,發放備案號,并按照相關格式要求制作備案憑證,備案人可通過系統自行打印備案憑證;不符合要求的,應當一次告知備案人補正相關材料。 備案人應當按要求保留一份完整的備案材料存檔備查。
申請材料
1.產品配方材料;
2.保健食品備案登記表,以及備案人對提交材料真實性負責的法律責任承諾書;>>保健食品備案登記表
3.營業執照;
4.產品生產工藝材料;
5.安全性和保健功能評價材料;
6.直接接觸產品的包裝材料的種類、名稱及標準;
7.產品標簽、說明書樣稿;
8.產品技術要求材料;
9.具有合法資質的檢驗機構出具的符合產品技術要求全項目檢驗報告;
10.產品名稱檢索材料;
11.表明產品安全性和保健功能的材料。
結果樣本

常見問題
問題1:備案人名稱、住所發生改變怎么辦?
答:當備案人名稱、地址發生改變后,備案人應對已獲得備案憑證的保健食品申請備案變更。省級食品藥品監督管理部門審核通過后,備案管理信息系統中將自動更新備案人相關信息。
本辦事指南摘自藥監局官網,如有變動,以官方發布為準。