聚焦全國兩會:創新藥研發難,目前藥品試驗數據保護還存在什么問題?
CIO專家-元參
聚焦全國兩會,全國人大代表、人福醫藥董事長李杰提出,由于新藥研發的成功率非常低,為了激勵新藥研發,防止仿制藥直接引用原研藥試驗數據,保護藥品研發知識產權,《藥品試驗數據保護制度》亟待完善。
據了解,很多發達國家和地區為保護藥品研發企業在上市許可過程中所提交的試驗數據,建立了藥品試驗數據保護制度,對不同類型的藥品給予相應的保護期。
目前,我國除了國家藥品監督管理局在2018年4月發布的《藥品試驗數據保護實施辦法(暫行)(征求意見稿)》外,尚沒有相關配套規章制度出臺。
一、什么是藥品試驗數據?
藥品試驗數據,指藥品上市申請人根據要求所提交的藥品上市注冊申請文件數據包中與藥品有效性相關的非臨床和臨床試驗數據。
二、藥品實驗數據保護制度任存在什么問題?
1、世界范圍內尚未形成統一的藥品試驗數據保護標準。
2、試驗數據保護申請是獲得藥品試驗數據保護的必要條件嗎?
3、首仿藥是否適用于數據獨占的保護方式?
4、享有試驗數據保護的藥品的仿制藥申請何時可以獲批,是期滿前或期滿后?
5、保護的試驗數據要求是未披露過的數據嗎?
三、我國現行的藥品試驗數據制度
2018年4月26日,藥監局公布的《藥品試驗數據保護實施辦法(暫行)(征求意見稿)》,針對不同的藥品類型給予不同的數據保護期,但是未提及監管機制和法律后果。
1、不包括對改良型創新藥和改良型生物制品。
2、仿制藥僅提交有關生物等效性的試驗數據。
3、藥品安全性相關的數據沒有納入“藥品試驗數據”受保護范圍。
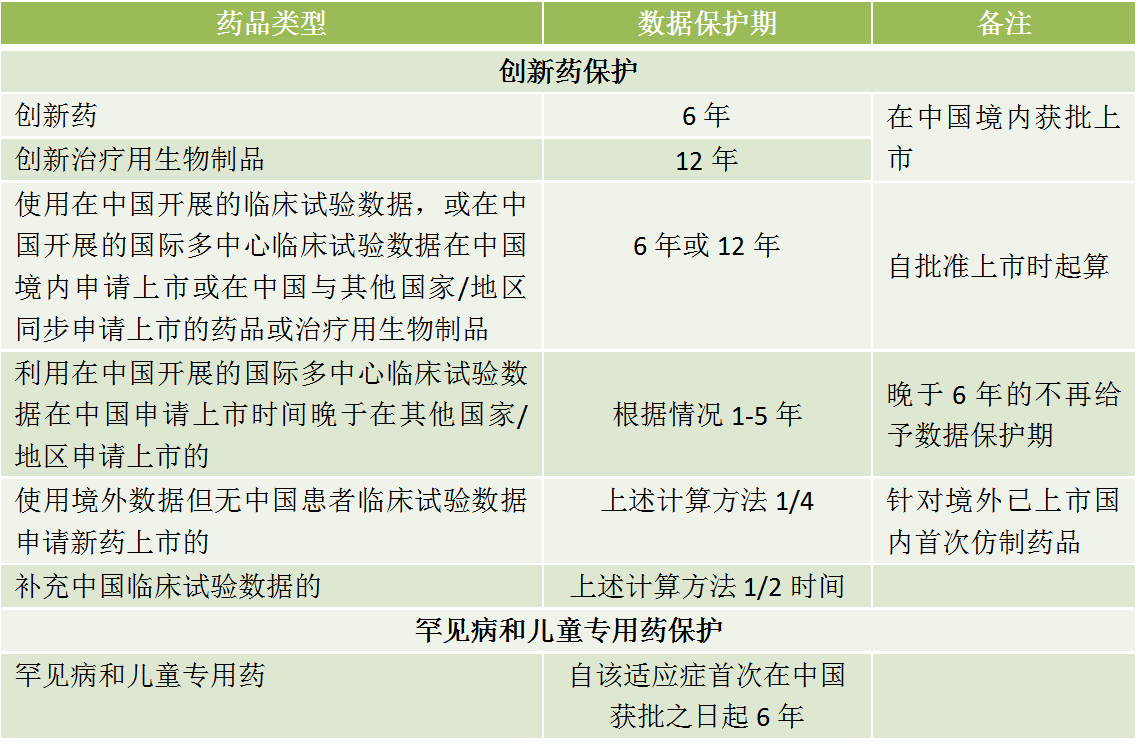
四、對比美國、歐洲和日本
以歐洲為例,對兒童藥、孤兒藥給予了10年的保護期,對創新藥品給予了8年的保護期加上2年的市場獨占期。該項制度的實施,基本可避免仿制藥直接引用原研藥試驗數據的現象,對保護藥品研發成果,促進藥品創新,推動醫藥產業發展具有重要意義。
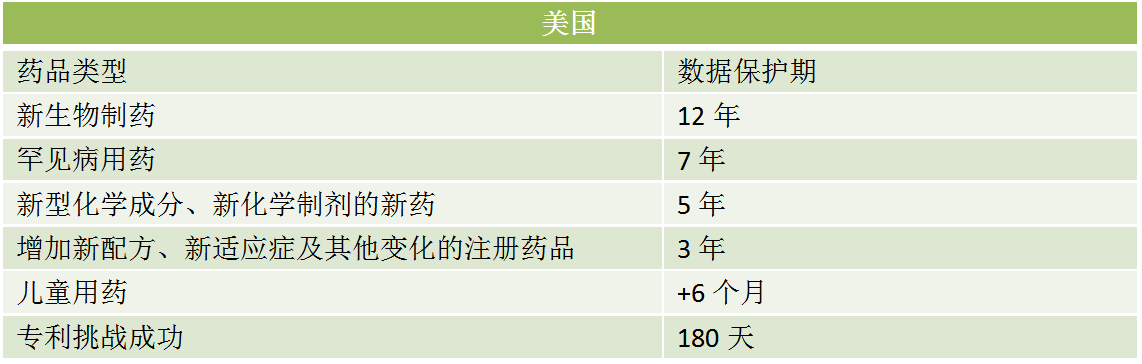
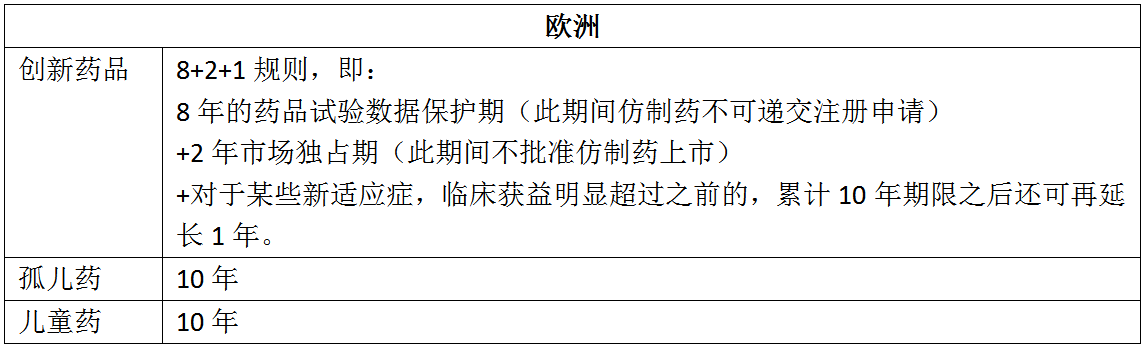
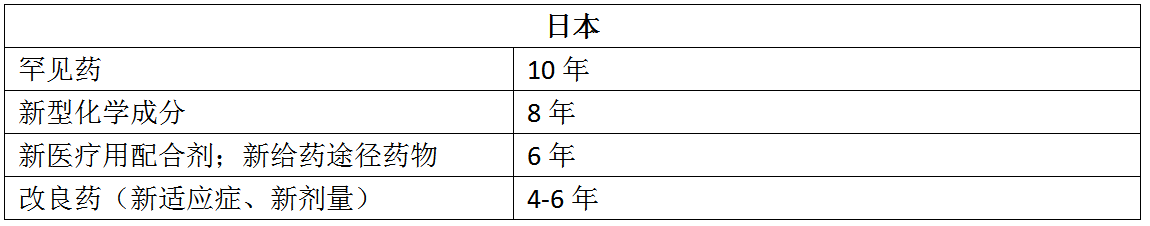
五、展望
隨著我國醫藥產業的快速發展,對創新藥、創新生物制品、兒童藥、罕見病用藥等藥品給予試驗數據獨占保護的時機已基本成熟。在《藥品試驗數據實施條例(暫行)》征求意見稿之際,我們應當對該制度進行完善,如明確我國的立法模式,清楚界定保護范圍,明確保護限制,制定實施細則,切實增強藥品試驗數據保護制度的可操作性,最終實現知識產權保護與公共健康平衡的目的。
相關文件下載、服務及學習課程:
合規文庫:藥品注冊管理辦法(2020年)
合規培訓:藥品注冊必備知識點
合規服務:藥品注冊申請
聯系專家,獲取專家指導意見:e邀專家























