藥品委托生產監管升級:B證MAH與受托企業的核心合規關注點
CIO專家-山丹
為深化藥品委托生產質量監管,確保藥品全生命周期安全,廣東局依據多項國家及地方藥品管理法規與指南,發布了《關于進一步加強廣東省藥品委托生產監督管理有關事項的通知》。本文聚焦于B證持有人(MAH)與受托企業在委托生產過程中的核心合規要點,為雙方提供了清晰的合規指引與解讀分析。
一、如何深化藥品委托生產質量監管,確保藥品全生命周期安全?
MAH制度實施后,醫藥產能顯著優化,但質量管理差異引發挑戰。2023年10月,國家藥監局發布“132號文”,即《國家藥監局關于加強藥品上市許可持有人委托生產監督管理工作的公告》,強化了藥品委托生產的許可、質量及監管要求。隨后,廣東藥監局于2024年7月發布細化通知,針對MAH與受托方,在許可管理、質量把控及監督執行等方面提出更具體規范,對公告內容進一步予以細化,相關要求對照如下。
1. 對B證MAH的上市后監督管理工作要求
除按上述法律法規和規章制度嚴格履行主體責任外,B證持有人還應重點關注以下幾個方面內容:
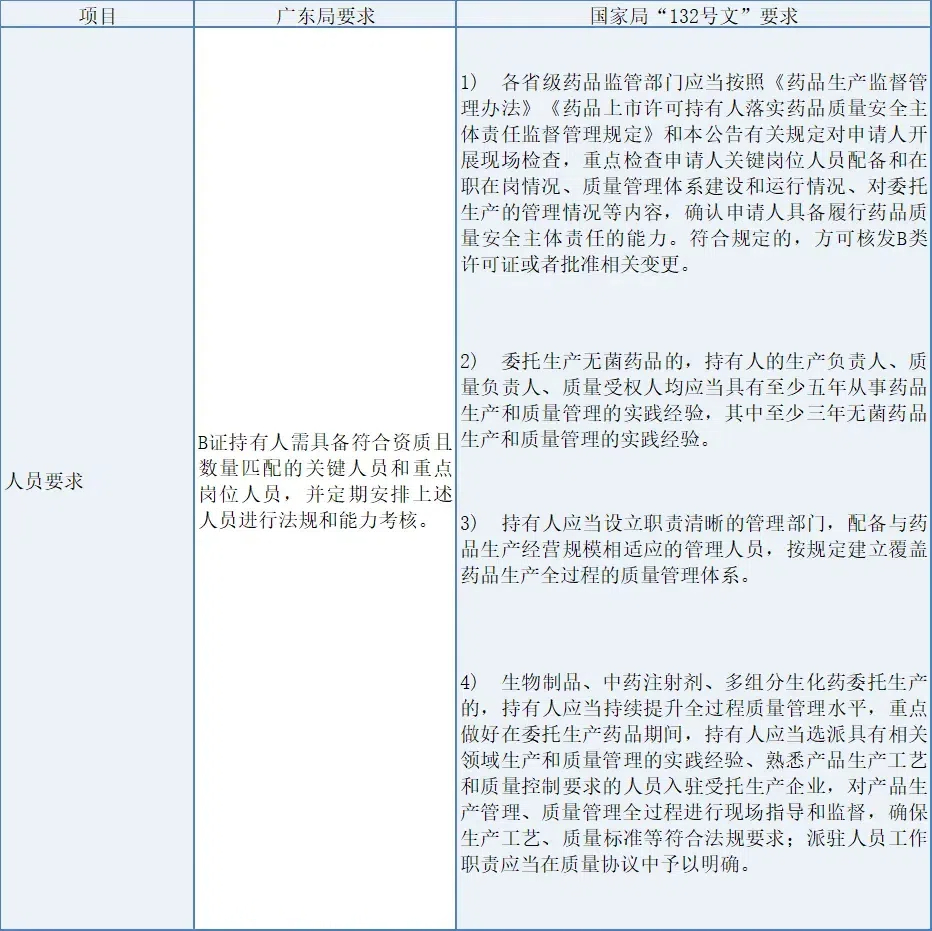
(1) 人員要求
廣東局對B證持有人強調關鍵人員資質、數量匹配及定期考核;國家局“132號文”要求省級藥監部門嚴格現場檢查,確保持有人關鍵崗位人員充足、在崗,質量管理體系健全。對于無菌藥品,特別強調高級管理人員的專業實踐經驗。此外,針對生物制品等高風險產品,要求持有人強化全過程質量管理,派駐專業人員入駐受托企業,確保生產合規。
(2) 質量管控
廣東局要求B證持有人在質量管控上需根據產品特性及風險,設定詳細內控標準,進行定期回顧與趨勢分析,并對多點委托生產實施一致性評估。而國家局“132號文”則強調持有人應制定上市放行規程,嚴格審核受托企業結果,并定期組織風險研判與回顧分析,每季度至少一次,以持續改進質量管理體系。兩者均重視基于風險的質量管理與持續改進。

(3) 檢驗管理
廣東局對B證持有人的檢驗管理要求詳盡,涵蓋自建或委托實驗室的監管、樣品管理、留樣控制及第三方檢驗的審核與報告。而國家局“132號文”則更側重于持有人對受托方檢驗條件的考核與監督,允許有限條件下的第三方檢驗,并強調風險評估指導下的檢驗項目設置,以及持有人對物料供應商、受托生產企業檢驗能力的審核與監督,確保藥品質量安全。兩者均強調全過程監督與合規性管理,但具體執行細節和側重點有所不同。

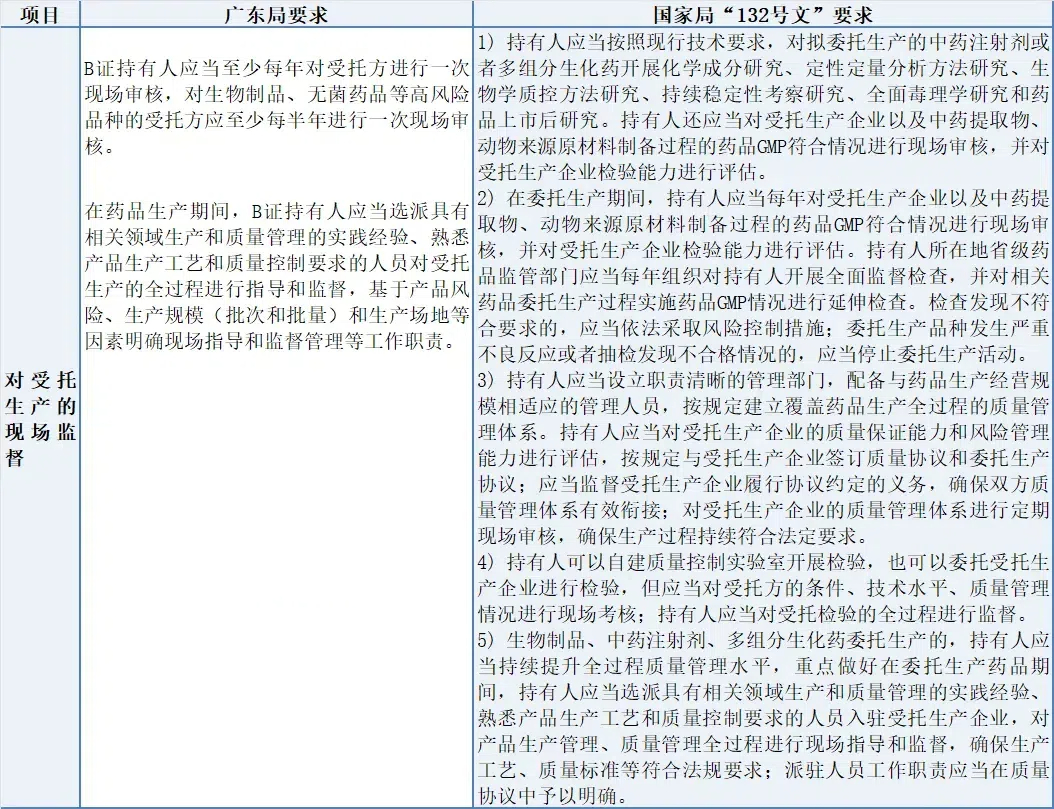
(4) 對受托生產的現場監督
廣東局對受托生產的現場監督強調高頻次審核與全過程指導,特別是高風險品種。而國家局“132號文”則除了現場審核和質量管理要求外,還涵蓋了研究、GMP符合性、檢驗能力評估、風險控制、協議管理等多維度內容,構建了全面的監管框架。兩者均重視現場審核與人員派駐,但國家局要求更為廣泛深入,涉及藥品研發、生產、質控及監管全鏈條,以確保委托生產的高質量實施。
(5) 建立溝通機制
廣東局要求B證持有人與受托方建立溝通機制,強調使用信息化手段記錄并保存溝通記錄,確保可追溯性,并明確了需溝通的具體情形,如質量問題、變更、偏差等;而國家局“132號文”對此未做具體要求。

2. 對受托生產企業的上市后監督管理工作要求
除按上述法律法規和規章制度嚴格履行主體責任,以及本通知中建立溝通機制的要求外,受托生產企業還應重點關注:
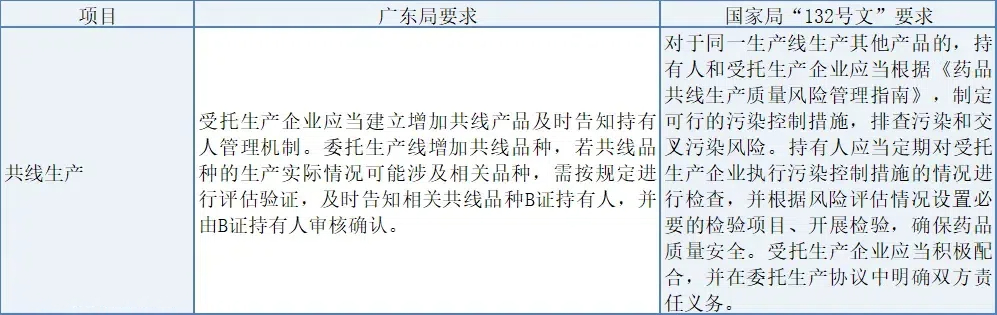
(1) 共線生產
廣東局要求受托方在共線生產時建立告知機制,確保B證持有人能評估驗證新增共線品種的影響;而國家局“132號文”則強調持有人與受托方需遵循共線生產風險管理指南,制定控制措施,定期檢查和檢驗,確保藥品質量,并在協議中明確雙方責任,體現了更全面的風險管理與質量保證體系。
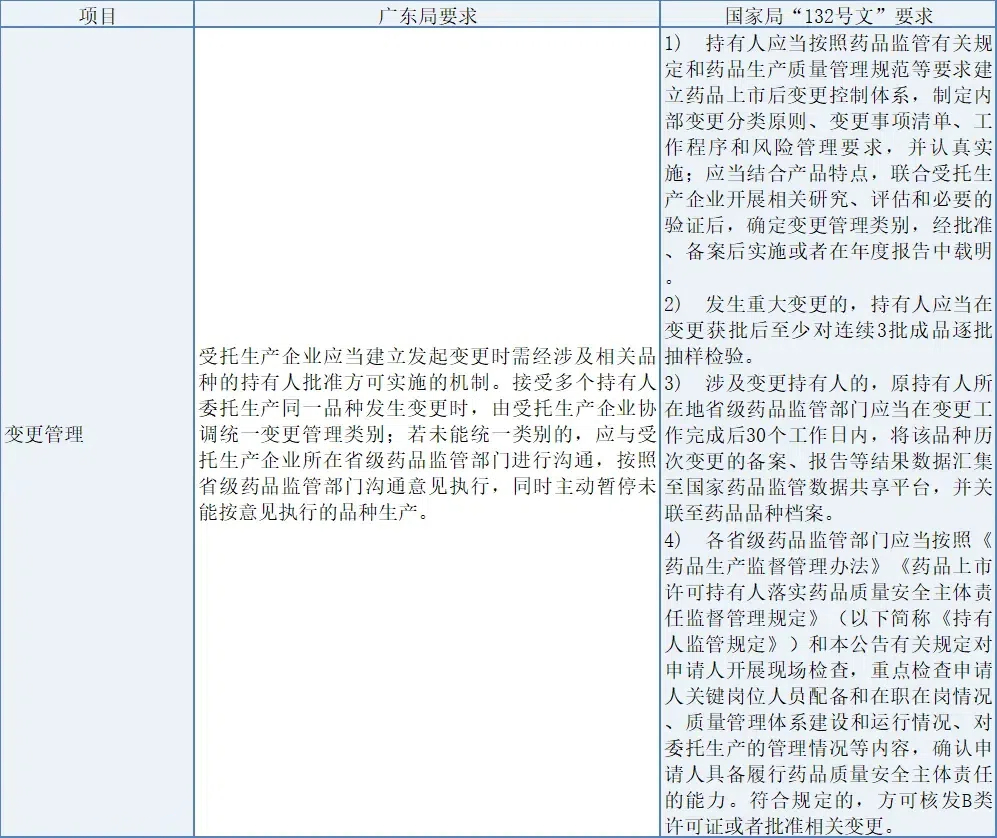
(2) 變更管理
廣東局要求受托方在變更管理時需經持有人批準,并協調統一變更管理類別,必要時與監管部門溝通;而國家局“132號文”則強調持有人需建立變更控制體系,聯合受托方評估變更,并根據變更類別實施或報告,對重大變更還需抽樣檢驗。此外,國家局還涉及變更后數據匯集、現場檢查等要求,確保持有人具備履行藥品質量安全主體責任的能力,體現了更全面的變更管理與監管體系。
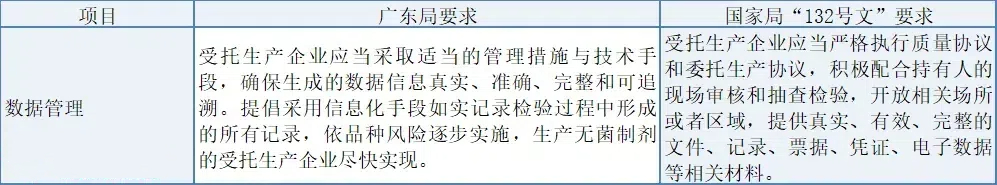
(3) 數據管理
廣東局強調受托方數據管理的真實、準確、完整與可追溯,推動信息化;國家局則要求受托方配合持有人審核與檢驗,提供真實完整材料,強調協議執行與配合度。
(4) 停產復產
廣東局對停產復產有詳細規定,要求停產報告、復產驗證及檢查,確保變更合規、工藝質量達標并考察穩定性;而國家局“132號文”對此未做具體要求。

*本文來源 - - 智藥公會微信公眾號
相關文件下載、服務及學習課程:
合規文庫:藥品上市許可持有人檢查要點(征求意見稿)
合規培訓:關于加強藥品上市許可持有人委托生產監督管理工作的公告(2023年第132號)解讀
委托定制:MAH委托生產審計
聯系專家,獲取專家指導意見:e邀專家
*以上文章僅代表作者個人觀點。本文為轉載文章,版權歸原作者所有,如涉侵權,請聯系我們刪除。























