基本信息
1、辦理部門:北京市藥品監督管理局
2、辦理方式:窗口辦理,網上辦理,快遞申請
3、辦理地點:
北京市政務服務中心——北京市豐臺區西三環南路1號(六里橋西南角)(1-3層綜合窗口)
北京城市副中心政務服務中心——北京市通州區新華東街48號二區(東南角)(綜合窗口)
4、咨詢電話: (010)89150290 CIO咨詢:400-003-0818
受理條件
(1)申請事項依法屬于本行政機關職權范圍; (2)企業提交材料為2套,申請材料應完整、清晰,要求簽字的須簽字,每份加蓋企業公章。使用A4紙打印或復印,裝訂成冊; (3)凡申請材料需提交復印件的,申請人須在復印件上注明日期,加蓋企業公章; (4)核對真實性的自我保證聲明應包括對承擔法律責任的承諾且應有法定代表人或負責人簽字并加蓋企業公章; (5)核對申請單位填報的表格,編寫的申報材料應為A4規格紙張,政府及其他機構出具的文件按原件尺寸比例提供,所報材料應清楚、整潔; (6)核對每份申報材料應加蓋企業公章,所有申報材料左頁邊距應大于20mm(用于裝訂); (7)核對申報材料中同一項目的填寫應一致,提供的復印件與原件一致、清晰。
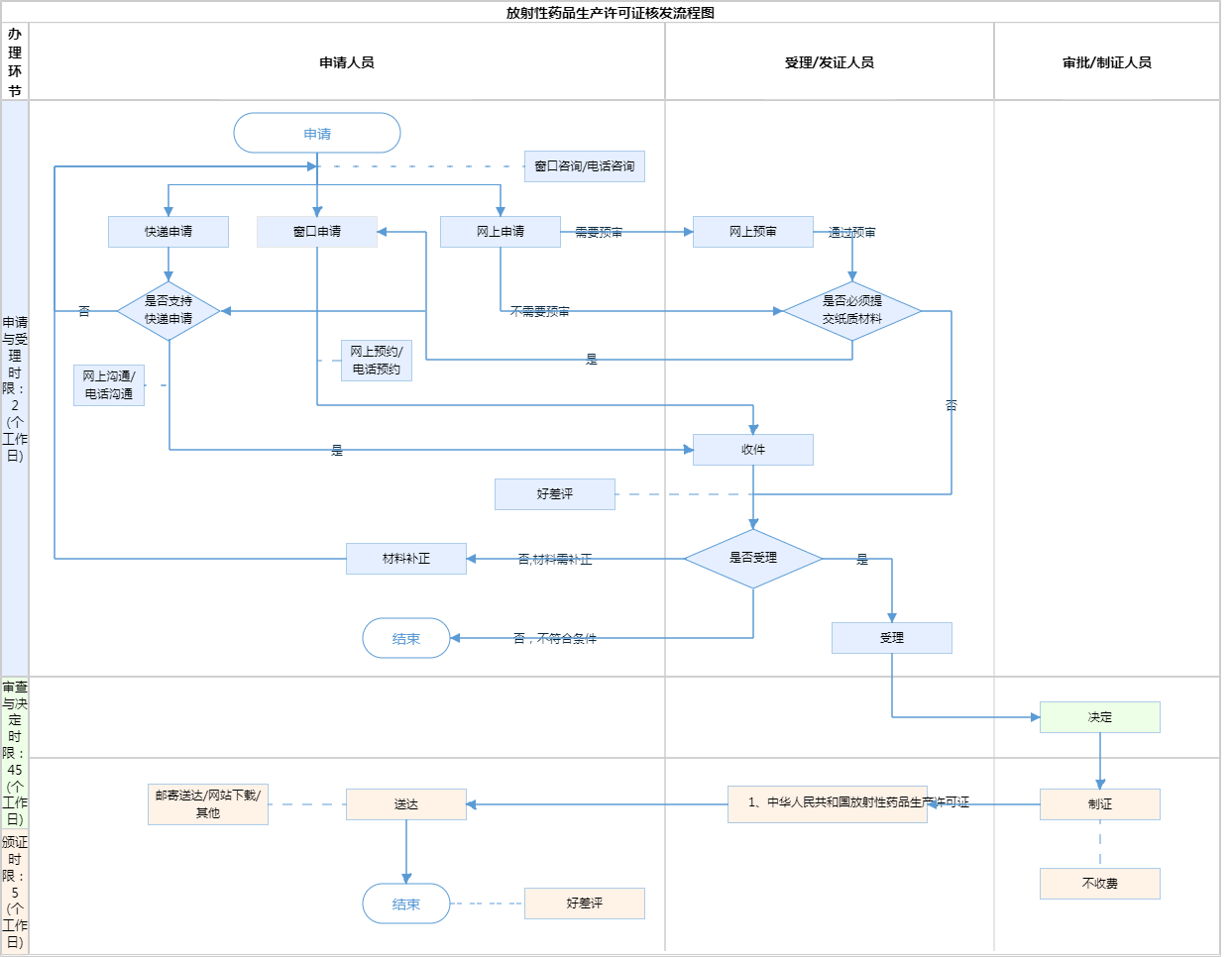
辦理流程
流程文字說明
1、受理(時限:2個工作日)
辦理結果:(1)能當場受理或者通過當場補正達到受理條件的,直接進入受理步驟,當場出具受理通知書;(2)根據一次性告知通知書內容進行補正后達到受理條件的,出具受理通知書;(3)收件之日起5個工作日內未收到一次性告知通知書的,從收件之日起即為受理。
2、決定(時限:20個工作日)
辦理結果:符合要求的,作出準予許可決定。
3、發證(時限:5個工作日)
辦理結果:中華人民共和國放射性藥品生產許可證;中華人民共和國放射性藥品生產許可證(副本)。
申請材料
一、放射性藥品生產許可證核發
1、放射性藥品生產許可證申請表;>>申請表
3、企業藥品生產質量管理組織機構設置及各部門職責;
4、生產管理、質量管理、質量檢驗、輻射安全管理部門人員配備情況;
5、法定代表人、企業負責人、生產負責人、質量負責人、質量受權人、輻射安全負責人等關鍵人員畢業院校、學歷、專業、技術職稱、工作經歷情況;
7、擬生產(或擬委托生產/擬受委托生產)的范圍、劑型、品種、生產工藝、質量標準及依據;
8、廠區環境和廠房情況,生產車間、檢驗場所、儲存場所布局平面圖;
9、生產車間和生產線的詳細情況;
10、主要生產設施設備、生產檢驗用儀器清單;
11、生產工藝布局平面圖(包括更衣室、盥洗間、人流和物流通道等,并標明人、物流向和空氣潔凈度等級)、空氣凈化系統的送風、回風、排風平面布置圖;
12、空氣凈化系統、制水系統、主要生產設備、生產工藝確認及驗證情況;
13、生產和檢驗用儀器、儀表、衡器檢定或校驗情況;
14、上市放行規程;
15、委托協議和質量協議;
16、受托方中華人民共和國放射性藥品生產許可證;
17、受托方所在地省級藥品監管部門出具的通過藥品GMP符合性檢查告知書以及同意受托生產的意見;
18、企業法人授權委托書;
19、申報材料真實性自我保證聲明;
二、放射性藥品生產許可證許可事項變更
1、放射性藥品生產許可證變更申請表;>>申請表
2、中華人民共和國放射性藥品生產許可證;
3、變更事項的基本情況說明;
4、法定代表人授權委托書;
5、申請材料真實性自我保證聲明;
符合辦理情形一、二、三,且生產地址、生產車間、生產線有實質變化的,除提交上述(一)資料外,還應提交以下資料
6、輻射安全許可證;
7、擬變更事項企業藥品生產質量管理組織機構設置及各部門職責;
8、擬變更事項生產管理、質量管理、質量檢驗、輻射安全管理部門人員配備情況;
9、擬變更事項生產管理、質量管理體系文件目錄;
10、擬變更事項擬生產(或擬委托生產/擬受委托生產)的范圍、劑型、品種、生產工藝、質量標準及依據、擬共線生產情況;
11、 擬變更事項廠區環境和廠房情況,生產車間、檢驗場所、儲存場所布局平面圖及生產車間和生產線的詳細情況;
12、擬變更事項主要生產設施設備、生產檢驗用儀器清單;
13、擬變更事項生產工藝布局平面圖(包括更衣室、盥洗間、人流和物流通道等,并標明人、物流向和空氣潔凈度等級)、空氣凈化系統的送風、回風、排風平面布置圖;
14、擬變更事項空氣凈化系統、制水系統、主要生產設備、生產工藝確認及驗證情況;
15、擬變更事項生產和檢驗用儀器、儀表、衡器檢定或校驗情況;
16、擬變更事項上市放行規程;
符合辦理情形一、三,辦理委托生產的,除提交上述(一)、(二)資料外,還應提交以下資料(持有人辦理多個品種同時委托一個受托方生產的,應合并辦理。應提交材料中有重復交叉的只需提交一份)
17、委托協議和質量協議;
18、持有人確認受托方變更后仍具有受托生產條件、技術水平和質量管理能力的評估報告;
19、輻射安全許可證;
20、擬生產(或擬委托生產/擬受委托生產)的范圍、劑型、品種、生產工藝、質量標準及依據、擬共線生產情況;
21、廠區環境和廠房情況,生產車間、檢驗場所、儲存場所布局平面圖;
22、生產車間和生產線的詳細情況;
23、主要生產設施設備、生產檢驗用儀器清單;
24、生產工藝布局平面圖(包括更衣室、盥洗間、人流和物流通道等,并標明人、物流向和空氣潔凈度等級)、空氣凈化系統的送風、回風、排風平面布置圖;
25、空氣凈化系統、制水系統、主要生產設備、生產工藝確認及驗證情況;
26、生產和檢驗用儀器、儀表、衡器檢定或校驗情況;
27、受托方中華人民共和國放射性藥品生產許可證;
28、受托方所在地省級藥品監管部門出具的通過藥品GMP符合性檢查告知書以及同意受托生產的意見;
符合辦理情形一、二、三,辦理受托生產的,除提交上述(一)資料外,還應提交以下資料(接受一個委托方同時委托生產多個品種的,應合并辦理。應提交材料中有重復交叉的只需提交一份。)
29、輻射安全許可證;
30、企業藥品生產質量管理組織機構設置及各部門職責;
31、生產管理、質量管理、質量檢驗、輻射安全管理部門人員配備情況;
32、法定代表人、企業負責人、生產負責人、質量負責人、質量受權人、輻射安全負責人等關鍵人員畢業院校、學歷、專業、技術職稱、工作經歷;
33、生產管理、質量管理體系文件目錄;
34、擬生產(或擬委托生產/擬受委托生產)的范圍、劑型、品種、生產工藝、質量標準及依據;
35、廠區環境和廠房情況,生產車間、檢驗場所、儲存場所布局平面圖;
36、主要生產設施設備、生產檢驗用儀器清單;
37、生產工藝布局平面圖(包括更衣室、盥洗間、人流和物流通道等,并標明人、物流向和空氣潔凈度等級);
38、空氣凈化系統、制水系統、主要生產設備、生產工藝確認及驗證情況;
39、生產和檢驗用儀器、儀表、衡器檢定或校驗情況;
40、出廠放行規程;
41、委托協議和質量協議;
符合辦理情形四的僅提交以下資料(按申請材料順序制作目錄。)
42、放射性藥品生產許可證變更申請表;>>申請表
43、中華人民共和國放射性藥品生產許可證;
44、變更證明文件;
45、法定代表人授權委托書;
46、申請材料真實性自我保證聲明;
擬變更藥品生產場地的還應提交以下資料(持有人應根據所申請事項,每個申報品種下順序提交申報資料,不適用的項目應注明不適用并說明理由)
47、藥品批準文件及其附件;
48、境內持有人及境內生產企業的中華人民共和國放射性藥品生產許可證及其變更記錄頁;
49、境內持有人及境內生產企業的營業執照;
50、檢查檢驗信息;
51、修訂的藥品質量標準、生產工藝信息表、說明書、標簽樣稿并附詳細修訂說明;
52、藥學研究資料;
53、藥理毒理研究資料;
54、臨床研究資料。
三、放射性藥品生產許可證登記事項變更(按申請材料順序制作目錄。)
1、放射性藥品生產許可證變更申請表;>>申請表
2、中華人民共和國放射性藥品生產許可證;
3、(變更放射性藥品生產企業企業名稱、統一社會信用代碼、注冊地址的還需提供)市場監督管理部門出具的變更后的營業執照及原營業執照;
4、(變更放射性藥品生產企業企業名稱、統一社會信用代碼、注冊地址的還需提供)變更后的輻射安全許可證;
5、(變更放射性藥品生產企業企業名稱、統一社會信用代碼、注冊地址的還需提供)董事會決議、重組協議、上級單位的決定性文件;
6、(變更放射性藥品生產企業法定代表人、企業負責人、質量負責人的還需提供)變更后人員學歷證書和職稱證件;
7、(變更放射性藥品生產企業法定代表人、企業負責人、質量負責人的還需提供)變更后人員工作簡歷;
8、(變更放射性藥品生產企業法定代表人、企業負責人、質量負責人的還需提供)藥品生產企業法定代表人、企業負責人、生產負責人、質量負責人、質量受權人變更的企業任命文件;
9、(變更放射性藥品生產企業法定代表人、企業負責人、質量負責人的還需提供)變更后人員無《藥品管理法》和《疫苗管理法》規定禁止從事藥品生產經營活動的情況說明;
10、法定代表人授權委托書;
11、申請材料真實性自我保證聲明。
四、放射性藥品生產許可證換證(同時具有兩種以上情形按照資料清單分別整合提交相關材料)
1、放射性藥品生產許可證申請表;>>申請表
2、中華人民共和國放射性藥品生產許可證;
3、營業執照;
4、輻射安全許可證;
5、組織機構圖;
6、法定代表人、企業負責人、生產負責人、質量負責人、質量受權人及部門負責人簡歷、學歷、職稱證書和身份證(護照);
7、生產管理、質量管理文件目錄;
8、藥品出廠、上市放行規程;
9、法定代表人授權委托書;
10、申請材料真實性自我保證聲明;
11、(藥品上市許可持有人自行生產的情形除(一)外還需提交)基本情況說明;
12、(藥品上市許可持有人自行生產的情形除(一)外還需提交)場地、周邊環境、基礎設施、設備企業條件說明以及投資規模情況說明;
13、(藥品上市許可持有人自行生產的情形除(一)外還需提交)周邊環境圖、總平面布置圖、倉儲平面布置圖、倉儲平面布置圖、質量檢驗場所平面布置圖;
14、(藥品上市許可持有人自行生產的情形除(一)外還需提交)生產工藝布局平面圖(包括更衣室、盥洗間、人流和物流通道、氣閘等,并標明人、物流向和空氣潔凈度等級);
15、(藥品上市許可持有人自行生產的情形除(一)外還需提交)擬生產的范圍、劑型、品種、質量標準及依據;
16、(藥品上市許可持有人自行生產的情形除(一)外還需提交)擬生產劑型及品種的工藝流程圖并注明主要質量控制點與項目、擬共線生產情況;
17、(藥品上市許可持有人自行生產的情形除(一)外還需提交)空氣凈化系統、制水系統、主要設備確認或驗證概況及生產、檢驗用儀器、儀表、衡器校驗情況;
18、(藥品上市許可持有人自行生產的情形除(一)外還需提交)主要生產設備及檢驗儀器目錄;
19、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)擬委托生產的范圍、劑型、品種、質量標準及依據;
20、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)擬委托生產劑型及品種的工藝流程圖并注明主要質量控制點與項目、受托方共線生產情況;
21、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)委托協議和質量協議;
22、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)持有人確認受托方具有受托生產條件、技術水平和質量管理能力的評估報告;
23、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)受托方中華人民共和國放射性藥品生產許可證;
24、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)受托方輻射安全許可證;
25、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)受托方藥品生產企業的場地、周邊環境、基礎設施、設備情況說明;
26、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)受托方周邊環境圖、總平面布置圖、倉儲平面布置圖、質量檢驗場所平面布置圖;
27、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)受托方生產工藝布局平面圖(包括更衣室、盥洗間、人流和物流通道、氣閘等,并標明人、物流向和空氣潔凈度等級);
28、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)受托方空氣凈化系統、制水系統、主要設備確認或驗證概況;
29、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)受托方生產、檢驗儀器、儀表、衡器校驗情況;
30、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)受托方主要生產設備及檢驗儀器目錄;
31、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)受托方藥品出廠放行規程;
32、(藥品上市許可持有人委托他人生產的情形除(一)外,還需提交)受托方所在地省級藥品監管部門出具的通過藥品GMP符合性檢查告知書以及同意受托生產的意見;
33、(藥品上市許可持有人接受委托生產還需提交)接受委托生產的場地、周邊環境、基礎設施、設備企業條件說明;
34、(藥品上市許可持有人接受委托生產還需提交)人員情況材料;
35、(藥品上市許可持有人接受委托生產還需提交)接受委托生產周邊環境圖、總平面布置圖、倉儲平面布置圖、質量檢驗場所平面布置圖;
36、(藥品上市許可持有人接受委托生產還需提交)接受委托生產線的生產工藝布局平面圖(包括更衣室、盥洗間、人流和物流通道、氣閘等,并標明人、物流向和空氣潔凈度等級);
37、(藥品上市許可持有人接受委托生產還需提交)擬接受委托生產的范圍、劑型、品種、質量標準及依據;
38、(藥品上市許可持有人接受委托生產還需提交)擬接受委托生產劑型及品種的工藝流程圖;
39、(藥品上市許可持有人接受委托生產還需提交)接受委托生產線的空氣凈化系統、制水系統、主要設備確認或驗證概況;
40、(藥品上市許可持有人接受委托生產還需提交)接受委托生產線的生產、檢驗儀器、儀表、衡器校驗情況;
41、(藥品上市許可持有人接受委托生產還需提交)主要生產設備及檢驗儀器目錄;
42、(藥品上市許可持有人接受委托生產還需提交)接受委托生產藥品的出廠放行規程;
43、(藥品上市許可持有人接受委托生產還需提交)委托協議和質量協議;
44、(藥品上市許可持有人接受委托生產還需提交)上一受托期間質量回顧報告。
結果樣本


常見問題
問題1:審批時限是多少個工作日?
答:法定20個,承諾10個。
本辦事指南摘自藥監局官網,如有變動,以官方發布為準。