基本信息
1、辦理部門:湖南省藥品監督管理局
2、辦理方式:窗口申請,網上辦理
3、辦理地點:湖南省長沙市天心區銀杏路6號政務服務大廳一樓B19-B26號窗口
4、藥監咨詢:0731-82213690 CIO咨詢:400-003-0818
受理條件
本省因教學、科研需要進口蛋白同化制劑、肽類激素的教學科研單位及藥品生產企業等。
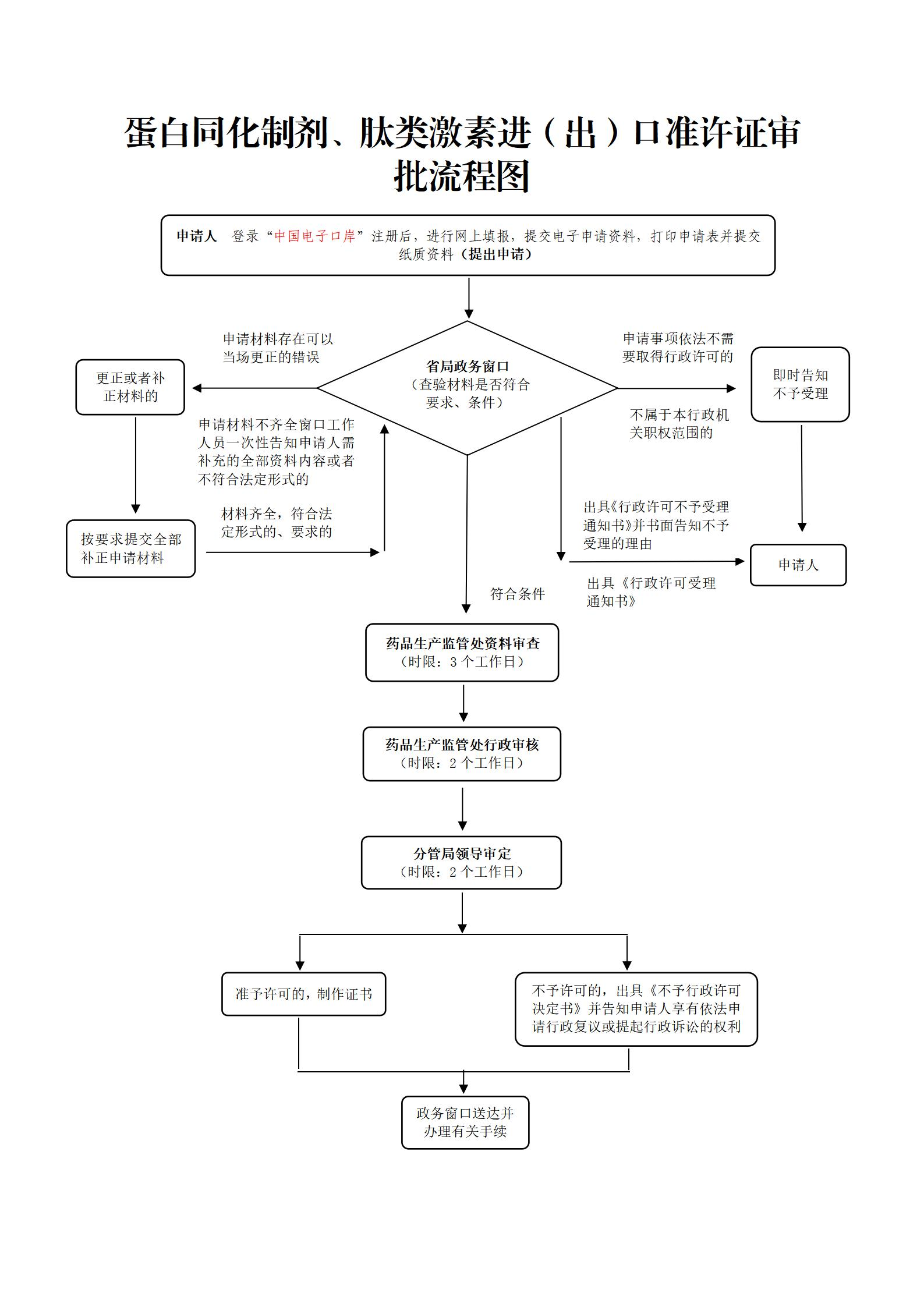
辦理流程
流程文字說明
法定辦結時限:15個工作日;承諾辦結時限:10個工作日。
1、受理
辦理結果:(1)申請事項依法不需要取得行政許可的,應當即時告知申請人不受理;
(2)申請事項依法不屬于本部門職權范圍的,應當即時作出不予受理的決定,并告知申請人向有關行政機關申請;
(3)申請材料存在可以當場更正的錯誤的,應當允許申請人當場更正;
(4)申請材料不齊全或者不符合形式審查要求的,應當當場或者在五日內發給申請人補正材料通知書,一次性告知申請人需要補正的全部內容,逾期不告知的,自收到申請材料之日起即為受理;
(5)申請材料齊全、符合形式審查要求,或者申請人按照要求提交全部補正材料的,予以受理;
(6)受理或者不予受理行政許可申請,應當出具加蓋本部門專用印章和注明日期的《受理通知書》或者《不予受理通知書》。
2、資料審查:3個工作日
辦理結果:《中華人民共和國藥品管理法》、《反興奮劑條例》、《蛋白同化制劑、肽類激素進出口管理辦法》、食品藥品監管總局《關于對取銷和下放行政審批事項加強事中事后監管的意見》(食藥監法〔2015〕65號)按照許可條件及申報材料要求對申請資料進行審查。
3、行政審核:2個工作日
辦理結果:辦人對申報資料進行綜合審查,提出并在審批表上簽署初審意見;處室負責人根據初審情況和意見在審批表上簽署審核意見;報分管局領導審定。
4、審定:2個工作日
辦理結果:對審核意見進行審定,符合法定條件的,作出行政許可決定,在審批表上簽署同意的意見;不符合法定條件的,不予許可,在審批表上簽署不同意的意見,并說明理由。
5、告知與送達
辦理結果:(1)對同意發《藥品進出口準許證》的,藥品生產監管處工作人員在審批系統中填寫并核對許可信息,由省局政務窗口制作《藥品進出口準許證》并送達申請人;(2)對不同意核發《藥品進出口準許證》的,由藥品生產監管處工作人員制作《不予行政許可決定書》,交省局政務窗口送達申請人;《不予行政許可決定書》中應書面說明不予許可理由,并告知申請人享有依法申請行政復議或提起行政訴訟的權利。
申請材料
1、蛋白同化制劑、肽類激素(進)出口準許證申請表;>>申請表
2、購貨合同或者訂單;
3、授權書;
4、承諾書;
5、《進口準許證》;
6、《對外貿易經營者備案登記表》;
7、《醫藥產品注冊證》;
8、《進出口企業資格證》;
9、公證文本;
10、出口國家中英文名稱對照表。
結果樣本

常見問題
問題1:進出口蛋白同化制劑、肽類激素有什么要求?
答:《反興奮劑條例》(2004年1月13日國務院令第398號,2014年7月29日予以修改)第十一條:進口蛋白同化制劑、肽類激素,除依照藥品管理法及其實施條例的規定取得國務院食品藥品監督管理部門發給的進口藥品注冊證書外,還應當取得省、自治區、直轄市人民政府食品藥品監督管理部門頒發的進口準許證。申請進口蛋白同化制劑、肽類激素,應當說明其用途。省、自治區、直轄市人民政府食品藥品監督管理部門應當自收到申請之日起15個工作日內作出決定;對用途合法的,應當予以批準,發給進口準許證。海關憑進口準許證放行。第十二條:申請出口蛋白同化制劑、肽類激素,應當說明供應對象并提交進口國政府主管部門的相關證明文件等資料。省、自治區、直轄市人民政府食品藥品監督管理部門應當自收到申請之日起15個工作日內作出決定;提交進口國政府主管部門的相關證明文件等資料的,應當予以批準,發給出口準許證。海關憑出口準許證放行。
本辦事指南摘自藥監局官網,如有變動,以官方發布為準。