基本信息
1、辦理部門:江蘇省藥品監督管理局
2、辦理方式:網上辦理
3、辦理地點:南京市建鄴區漢中門大街145號江蘇省政務服務中心省藥監局窗口
4、咨詢電話: 12315 CIO咨詢:400-003-0818
受理條件
《中華人民共和國行政許可法》第三十二條第五項: 申請事項屬于本行政機關職權范圍,申請材料齊全、符合法定形式,或者申請人按照本行政機關的要求提交全部補正申請材料的,應當受理行政許可申請。
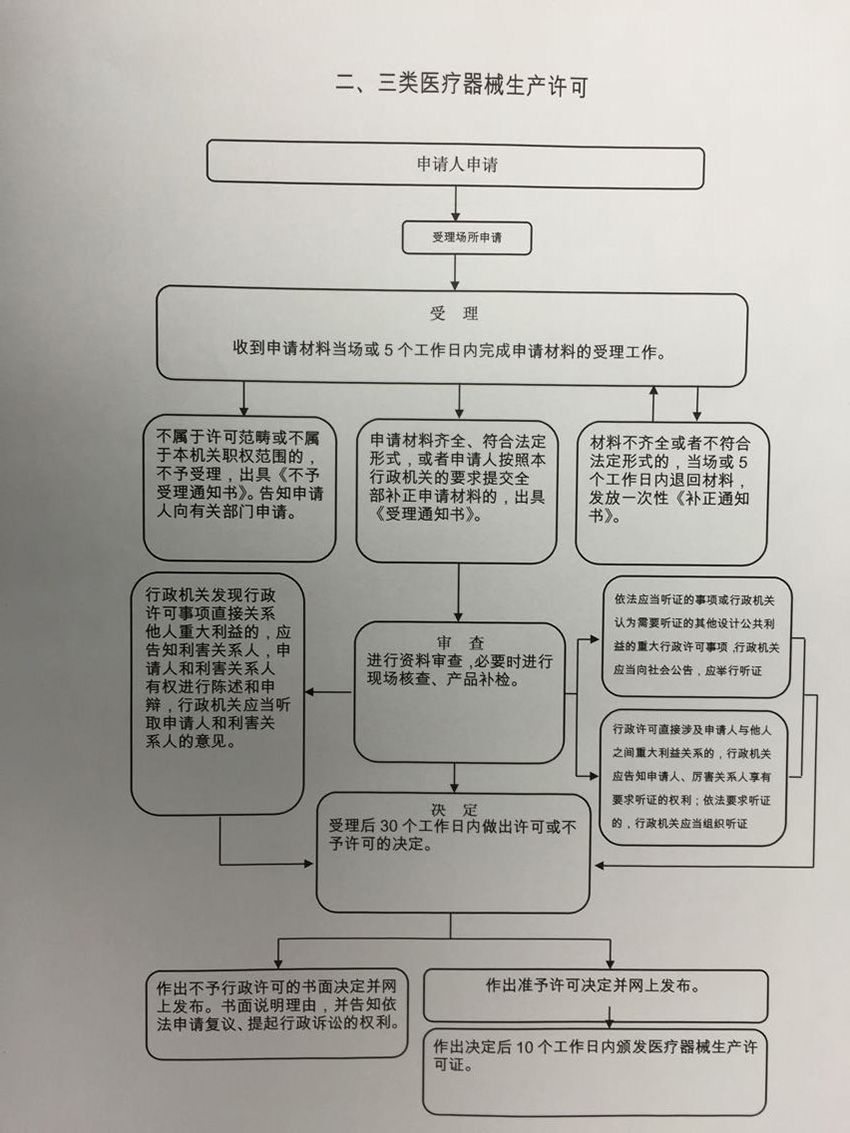
辦理流程
流程文字說明
1、審查、決定(時限:20個工作日)
辦理結果:根據《醫療器械生產監督管理辦法》,對申請材料進行實質內容審查,并做出決定。
申請材料
1、1.醫療器械生產許可事項變更申請表;>>申請表
2、2.變更情況說明(包括變更事項及原因);
3、3.醫療器械生產許可證正本、副本;
4、4.生產場地的相關文件;
5、4.1申請人產權證明、租賃合同復印件;
6、4.2生產地址地理位置圖;
7、4.3廠區平面布局;
8、4.4有特殊生產環境要求的,還應當提交設施、環境的相 關文件(如潔凈車間平面布局圖、新潔凈區有資質機構出具的潔凈車間環境檢驗合格報告/原潔凈區符合標準要求的最新環境監測合格報告/含全部或部分項目委托有資質機構檢測的最新環境監測合格報告、輻射防護證明文件);
9、5.主要生產設備和檢驗設備目錄;
10、5.1主要生產設備器具目錄;
11、5.2進貨、過程、成品檢驗設備目錄;
12、5.3進貨、過程、成品檢驗規程;
13、6.質量手冊和程序文件目錄;
14、6.1質量手冊和程序文件目錄;
15、6.2醫療器械質量管理規范等現場檢查申請表;>>核查申請表
16、6.3現場檢查的特別說明(如申請部分產品現場考核、書面審核或免于現場考核等情形的理由及證明資料,如適用);
17、6.4現場考核后提交現場檢查記錄表(含情況說明,如適用);
18、6.5企業整改報告(如適用);
19、6.6復查申請和/或復查報告(如適用);
20、7.產品詳細工藝流程圖(需注明主要生產方式、外購外協件、關鍵工序和特殊過程及各工序的生產環境要求);
21、8.新場地所有試生產及檢驗情況說明(增加生產地址時需提供);
22、9.經辦人的授權文件;>>授權委托書
23、10.資料真實性保證聲明(含申請企業承諾)。>>承諾書
結果樣本

常見問題
問題1:生產企業取得注冊證后還需要去補充生產許可證的相關手續嗎?
答:生產企業取得了產品注冊證后,如果還未取得生產許可證的生產企業,需申請辦理醫療器械生產許可證;如果已取得生產許可證的生產企業,辦理生產許可變更手續(增加新產品)。
問題2:現有生產許可證在有效期內,新產品取得注冊證后,必須要做許可證變更么?
答:生產企業取得新的產品注冊證后,必須辦理生產許可證變更手續,即增加新產品變更。
本辦事指南摘自藥監局官網,如有變動,以官方發布為準。