基本信息
1、辦理部門:國家藥品監督管理局
2、辦理方式:窗口辦理,網上辦理,快遞申請
3、辦理地點:北京市豐臺區南四環西路188號12區29號樓
4、藥監咨詢:010-53815833 CIO咨詢:400-003-0818
受理條件
申請事項屬于本行政機關職權范圍,申請材料齊全、符合法定形式,或者申請人按照本行政機關的要求提交全部補正申請材料的,受理行政許可申請。
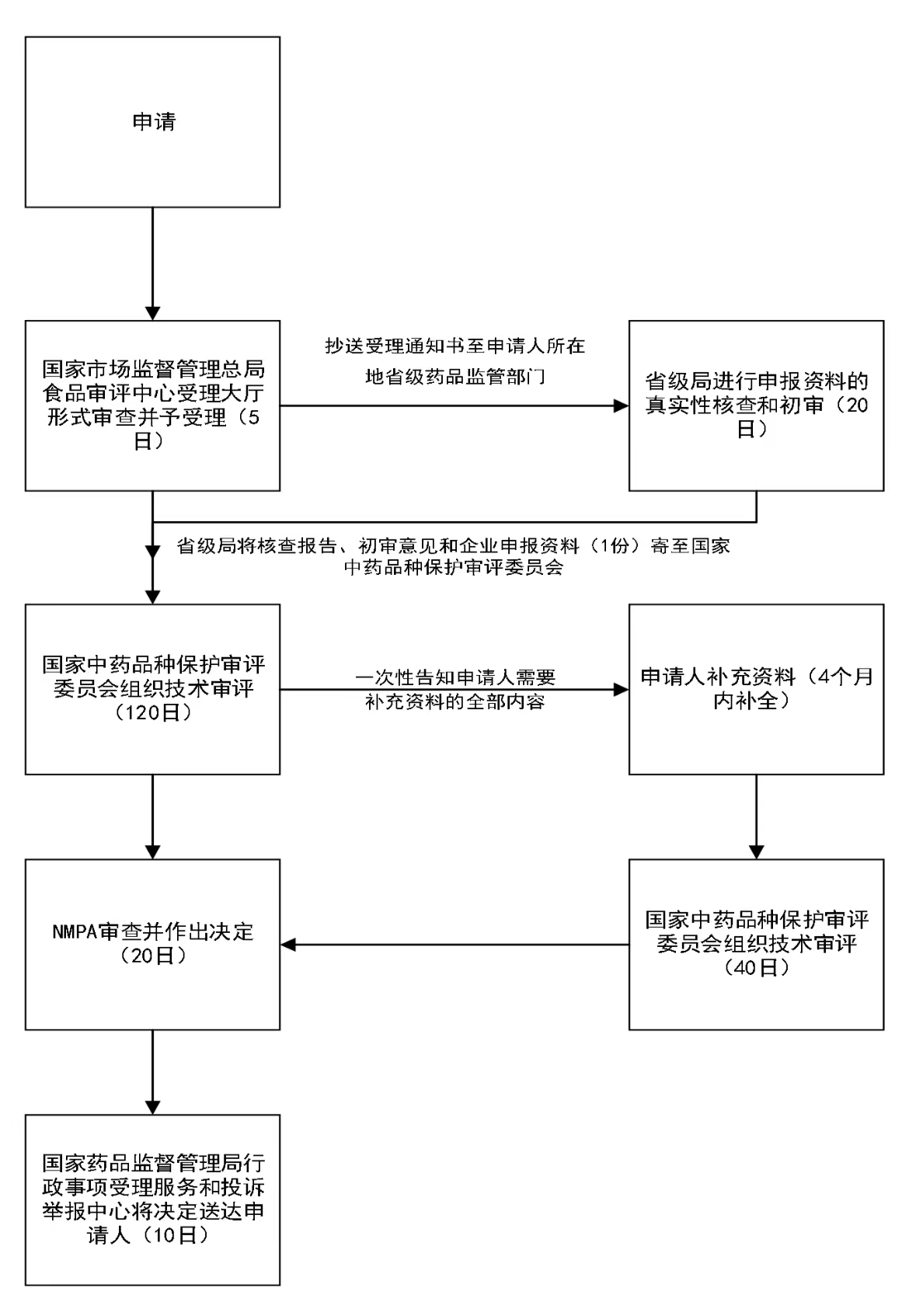
辦理流程
流程文字說明
法定辦結時限:20個工作日;承諾辦結時限:5個工作日
1、受理;
2、初審(必要時組織現場檢查);
3、技術評審(國家中藥品種保護審評委員會組織專家評審);
4、行政許可決定;
5、送達。
申請材料
1、《中藥品種保護申請表》。>>中藥品種保護申請表
2、證明性文件:初次保護申請企業應提供其為原研企業的證明資料;現行國家標準、說明書和標簽實樣;專利權屬狀態說明書及證明文件。
3、申請保護依據與理由綜述。
4、醫學相關資料(批準上市前研究資料、批準上市后研究資料)。
5、藥學相關資料(批準上市前研究資料、批準上市后研究資料)。
6、藥理毒理相關資料(批準上市前研究資料、批準上市后研究資料)。
7、擬改進提高計劃與實施方案。
結果樣本



常見問題
問題1:中藥新藥使用原有的注冊資料申報初次保護需要注意哪些問題?
答:需注意原注冊資料能否說明申報品種具有臨床療效優勢。若現有的臨床試驗資料基本規范完整,僅能說明臨床用藥安全有效的,還需進一步提供資料證明其臨床療效優勢。
企業可再進行100對的臨床觀察;多適應癥的,可結合臨床實際應用情況重點觀察某一個主要適應癥,如觀察多個適應癥,每個適應癥要求不少于60對,以探討申報品種是否具有療效優勢。
問題2:簡單改劑型品種已與原劑型進行了臨床對照試驗,申請初次保護是否還需要另行開展臨床試驗?
答:需要另行開展臨床試驗。與原劑型對照的臨床試驗,僅能用于證明改劑型的合理性,申請初次保護仍要求開展與同類藥比較的臨床試驗以證明其臨床療效優勢。
問題3:初次保護申請開展上市后臨床觀察需遵循什么原則?
答:建議結合申報品種的實際臨床應用情況,參照《藥品注冊管理辦法》Ⅲ期臨床研究相關要求,進行試驗設計,選擇合適的對照藥進行臨床比較觀察,疾病(癥狀、證候)的診斷和療效評價需采用現行公認的技術標準。
問題4:獨家生產的品種法定質量標準欠完善,申報初次保護應注意哪些問題?
答:①首先應先行提高質量標準,并經省級藥檢所復核認可;②其次企業還要將提高標準納為企業內控質量標準,在生產過程中按GMP要求嚴格執行;③申報資料中應有企業按照內控標準進行產品質量控制的有關資料。
本辦事指南摘自藥監局官網,如有變動,以官方發布為準。