基本信息
1、辦理部門:國家藥品監督管理局
2、辦理方式:窗口辦理,網上辦理,快遞辦理
3、辦理地點:北京市西城區宣武門西大街28號大成廣場3門1層
4、藥監咨詢:010-88331776(周三、周四全天) CIO咨詢:400-003-0818
受理條件
申請變更注冊的產品符合安全、有效、質量可控要求,注冊申請人具有保證醫療器械安全、有效的質量管理能力。
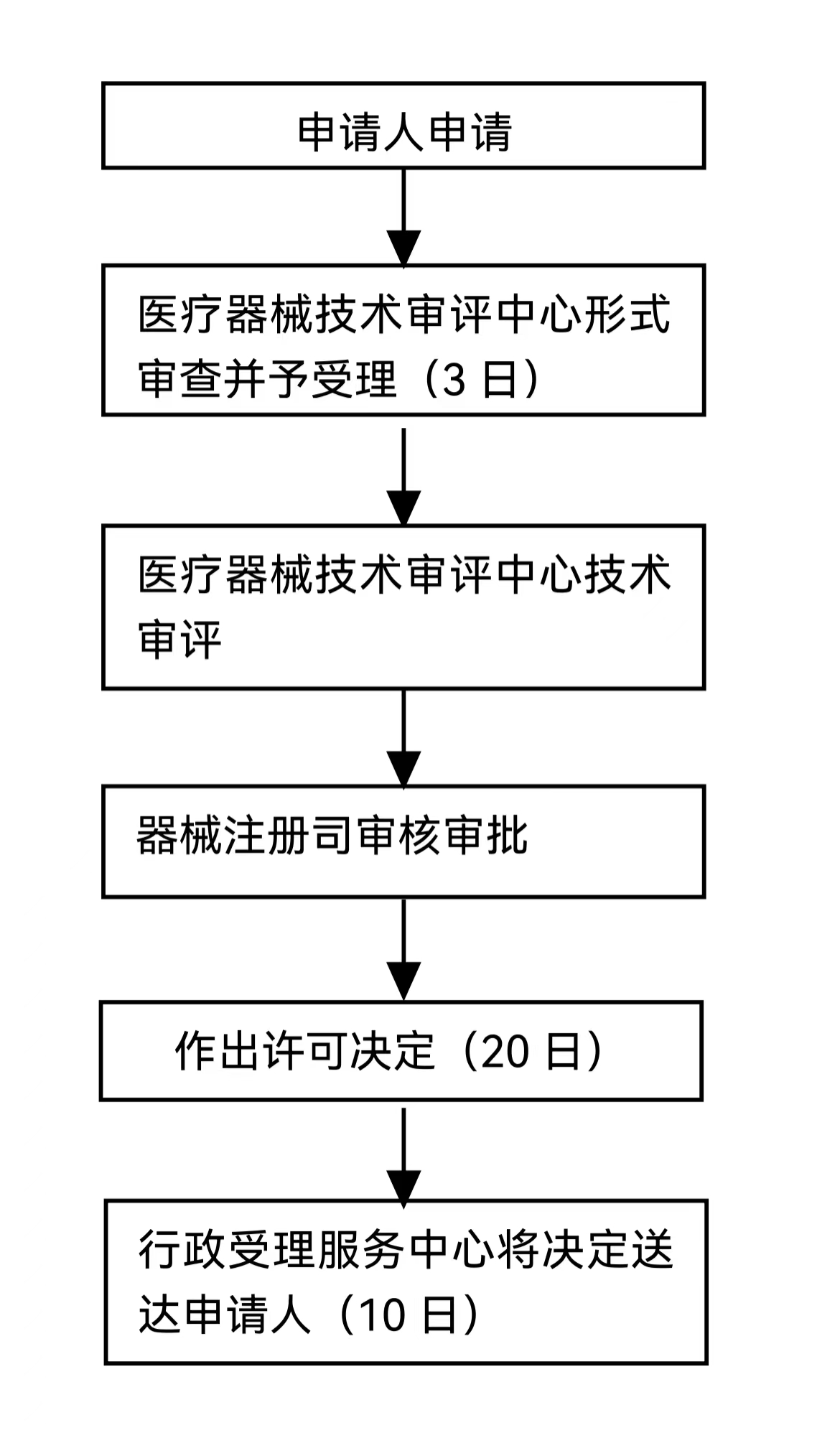
辦理流程
流程文字說明
法定辦結時限:20個工作日;承諾辦結時限:5個工作日
1、申請人申請。
2、國家藥品監督管理局受理/不予受理。
3、技術審評機構審評通過/不予通過(必要時,組織開展質量管理體系核查;對于擬作出不通過的審評結論的,申請人可以提出異議)。
4、國家藥品監督管理局準予變更/不予變更(必要時,開展現場勘驗或組織聽證的)。
5、送達。
申請材料
1、監管信息。
2、綜述資料。
3、非臨床資料。
4、臨床評價資料。
5、產品說明書。
6、質量管理體系文件。
結果樣本



常見問題
問題1:如何準備臨床評價資料?
答:行政相對人可參考《國家藥監局關于發布醫療器械臨床評價技術指導原則等5項技術指導原則的通告》(2021年第73號)準備臨床評價資料。
本辦事指南摘自藥監局官網,如有變動,以官方發布為準。