基本信息
1、辦理部門:江蘇省藥品監督管理局
2、辦理方式:網上辦理
3、辦理地點:南京市建鄴區漢中門大街145號江蘇省政務服務中心省藥監局窗口
4、咨詢電話: 12315 CIO咨詢:400-003-0818
受理條件
《中華人民共和國行政許可法》第三十二條第五項: 申請事項屬于本行政機關職權范圍,申請材料齊全、符合法定形式,或者申請人按照本行政機關的要求提交全部補正申請材料的,應當受理行政許可申請。
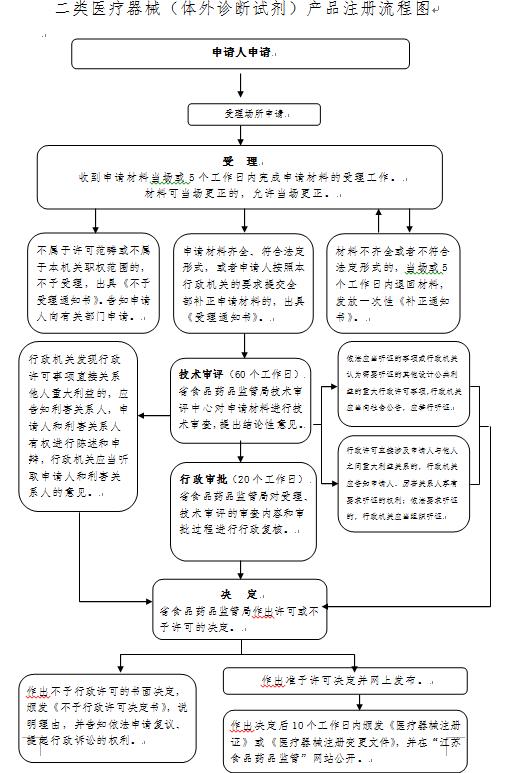
辦理流程
流程文字說明
1、受理(時限:5個工作日)
辦理結果:在5個工作日內, 對不屬于許可范疇或不屬于本機關職權范圍的,不予受理,并出具《不予受理通知書》;對申請資料不齊全或不符合法定形式的,出具《補正通知書》,一次性告知申請人需要補正的全部內容;對申報資料齊全或已經按照要求提交全部補正申請資料的申請作出受理決定,出具《受理通知書》。
2、審評核查(時限:40個工作日)
辦理結果:根據《體外診斷試劑注冊與備案管理辦法》等有關法規,對申請進行技術審評、核查。
3、審批(時限:10個工作日)
辦理結果:根據《體外診斷試劑注冊與備案管理辦法》等有關法規,對申請材料進行實質內容審查,并做出決定。
4、制證(時限:5個工作日)
辦理結果:發放醫療器械注冊證(體外診斷試劑)。
申請材料
1、1.監管信息;
2、1.1章節目錄;
3、1.2申請表;>>申請表
4、1.3關聯文件;
5、1.4申報前與監管機構的聯系情況和溝通記錄;
6、1.5符合性聲明;>>承諾書
7、2.綜述資料;
8、2.1章節目錄;
9、2.2概述;
10、2.3產品變更情況描述;
11、2.4變更對產品安全性、有效性影響的技術分析;
12、3.非臨床資料;
13、3.1章節目錄;
14、3.2產品風險管理資料;
15、3.3產品技術要求;
16、3.4產品檢驗報告;
17、3.5分析性能研究;
18、3.6穩定性研究;
19、3.7陽性判斷值或參考區間研究;
20、3.8需說明的資料;
21、4.臨床評價資料(需要進行臨床評價的第二類體外診斷試劑,注冊人應根據具體變更情況,基于變化部分對產品安全性、有效性影響的論述,必要時采用適當的方法進行臨床評價并按照以下要求提交資料);
22、4.1章節目錄;
23、4.2臨床評價資料要求;
24、5.產品說明書;
25、5.1章節目錄;
26、5.2產品說明書;
27、6.質量管理體系文件(已注冊產品發生前述變更情形的,注冊人應當承諾已根據產品變更的具體情況,按照法規要求對已建立的質量管理體系進行相應調整,并隨時接受質量管理體系核查。 注冊人提出變更的具體原因或目的涉及原材料、生產工藝變化的,應當針對變化部分進行質量管理體系核查;除此以外的變化,一般不需進行質量管理體系核查。 需要進行質量管理體系核查的,應當按照要求提交本部分資料);
28、6.1綜述;
29、6.2章節目錄;
30、6.3生產制造信息;
31、6.4質量管理體系程序;
32、6.5管理職責程序;
33、6.6資源管理程序;
34、6.7產品實現程序;
35、6.8質量管理體系的測量、分析和改進程序;
36、6.9需說明的質量體系程序信息;
37、6.10質量管理體系核查文件;>>質量管理體系核查文件
38、7.需要說明的申請資料(委托生產適用);
39、7.1關聯文件(委托生產適用);
40、7.2產品說明書(委托生產適用);
41、7.3質量管理體系文件(委托生產適用)。
結果樣本

常見問題
問題1:什么情況下需要申請體外診斷試劑注冊證變更?
答:已注冊的第二類、第三類醫療器械產品,其設計、原材料、生產工藝、使用范圍、使用方法等發生實質性變化,有可能影響該醫療器械安全、有效的,注冊人應向原注冊部門申請辦理變更注冊手續。
本辦事指南摘自藥監局官網,如有變動,以官方發布為準。