基本信息
1、辦理部門:國家藥品監督管理局
2、辦理方式:窗口辦理,網上辦理
3、辦理地點:北京大興區華佗路31號(疫苗)、東城區天壇西里2號(體外診斷試劑)及指定的省級批簽發機構所在地
4、藥監咨詢:大興院區 010-53852424、天壇院區 010-67095260 CIO咨詢:400-003-0818
受理條件
批簽發申請人應當是持有藥品批準證明文件的境內外制藥企業。境外制藥企業應當授權其駐我國境內辦事機構或者我國境內企業法人作為代理人辦理批簽發。批簽發申請人在每批產品銷售前或者進口時,按照生物制品批簽發管理辦法的要求,提供相關文件進行生物制品批簽發申請。
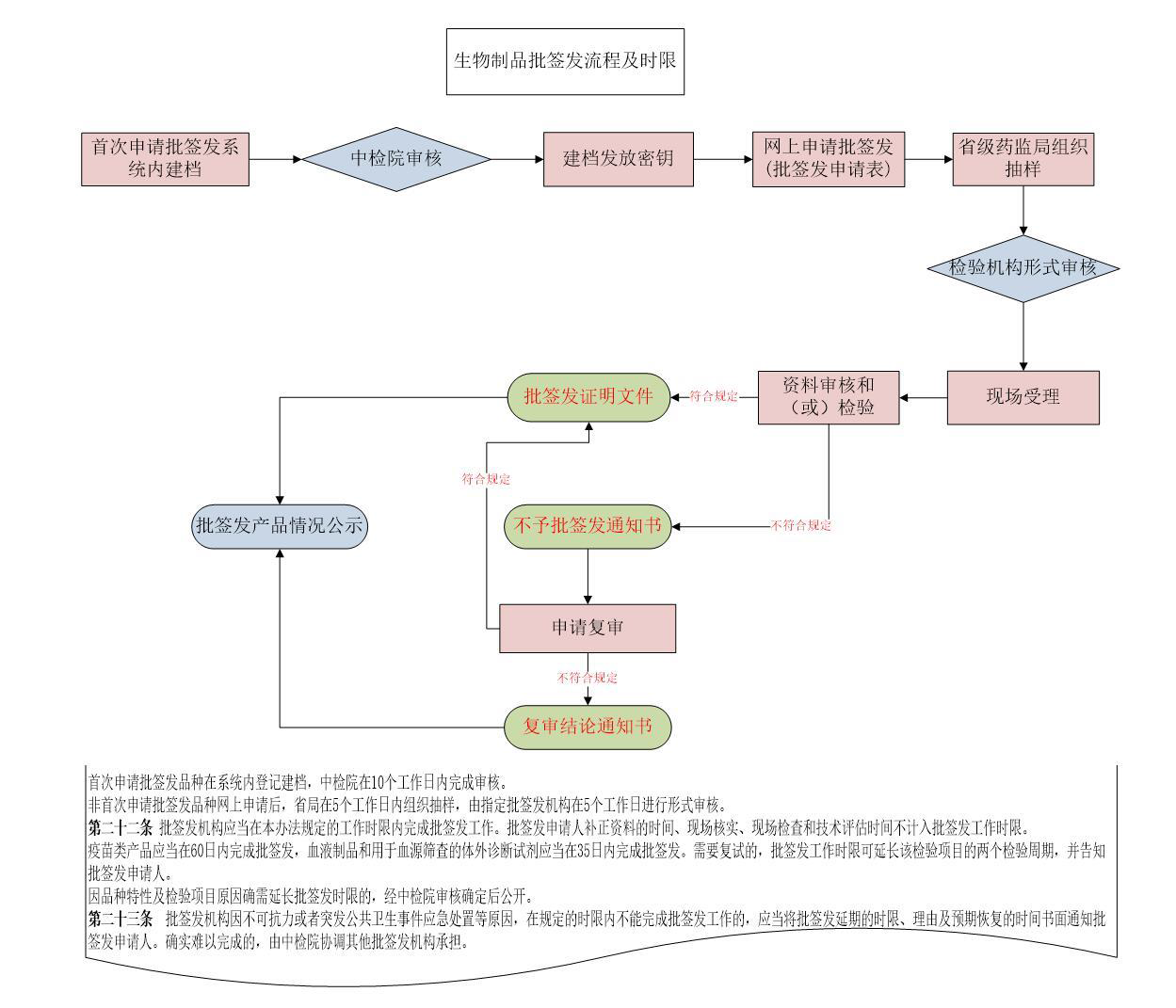
辦理流程
流程文字說明
法定辦結時限:60個工作日;承諾辦結時限:3個工作日
1、申請人申請;
2、批簽發機構受理/不予受理;
3、批簽發機構開展資料審核和樣品檢驗,可根據需要開展現場核實、現場檢查;
4、出具生物制品批簽發證明或生物制品不予批簽發通知書;
5、送達。
申請材料
1、生物制品批簽發申請表。
2、生物制品批簽發現場抽樣記錄表。
3、批生產及檢定記錄摘要或全套制檢記錄。
4、藥品批準證明文件。
5、合法生產的證明性文件。
6、上市后變更的批準證明性文件。
7、質量受權人等關鍵人員變動情況的說明。
8、進口產品同時提交生產企業所在國家或者地區的原產地證明以及藥品管理當局出具的批簽發證明文件。
結果樣本

常見問題
問題1:申請批簽發需要送檢樣品數量?
答:一般情況送檢樣品應為申請批簽發的同批號產品,數量應該是一次檢驗用量的3倍。特殊情況下經中檢院事先確認,可酌情減量,但不得少于檢驗用兩倍量。必要時需提供與檢驗相關的中間產品、標準物質、試劑等材料。
本辦事指南摘自藥監局官網,如有變動,以官方發布為準。