基本信息
1、辦理部門:江蘇省藥品監督管理局
2、辦理方式:窗口辦理,網上辦理,快遞申請
3、辦理地點:南京市建鄴區漢中門大街145號江蘇省政務服務中心省藥監局窗口
4、咨詢電話: 12315 CIO咨詢:400-003-0818
受理條件
材料齊全,符合法定形式。
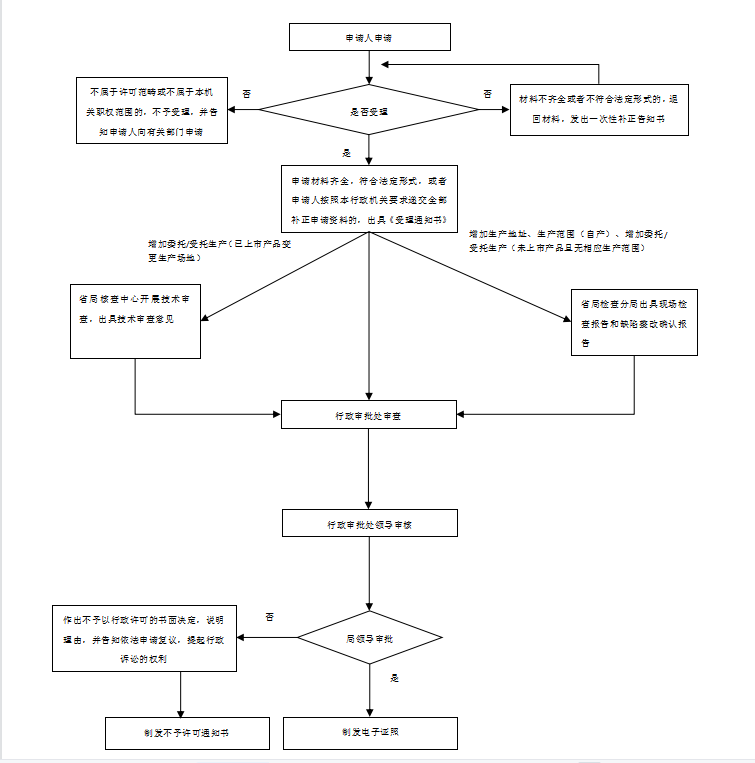
辦理流程
流程文字說明
1、受理(時限:5個工作日)
辦理結果:在5個工作日內,對不屬于許可范疇或不屬于本機關職權范圍的,不予受理,并出具《不予受理通知書》;對申請資料不齊全或不符合法定形式的,出具《補正通知書》,一次性告知申請人需要補正的全部內容;對申報資料齊全或已經按照要求提交全部補正申請資料的申請作出受理決定,出具《受理通知書》。
2、審查(時限:10個工作日)
辦理結果:符合許可要求的,制作《藥品生產許可證》正副本。不符合許可要求的,出具《不予許可通知書》。
3、送達(時限:0個工作日)
辦理結果:藥品生產行政審批系統對接省局智慧政務服務平臺(供企業查看、下載、打印)。
申請材料
1、企業申請報告(說明此次變更的背景、原因等);
2、《藥品生產許可證變更申請表》;>>《藥品生產許可證》變更申請表
3、原《藥品生產許可證》正副本和《營業執照》正副本(系統自動獲取);
4、企業負責人任命書或公司董事會決議、簡歷及身份證復印件;
5、企業負責人無違反《藥品管理法》和《疫苗管理法》禁止從事藥品生產經營活動規定的承諾書;
6、申報單位對申報資料的真實性作的保證聲明;>>承諾書
7、經辦人不是法定代表人本人,企業應當提交《法定代表人授權委托書》及被委托人身份證復印件。
結果樣本

常見問題
問題1:變更企業負責人或者質量負責人,體系文件需要重新簽嗎?
答:變更企業負責人或者質量負責人時,建議先進行專項內審,專項內審內容除“人員與培訓”的任職要求外增加“質量管理體系文件”項目,如內審結果表明變更后質量體系文件能持續有效、合法合規運行的,則無需更新簽名;如內審發現質量體系文件有需要修改的,則需要按企業《質量管理文件的管理》進行部分修訂、替換,或進行全部修訂,新修訂的文件由新的企業負責人或質量負責人簽名。
本辦事指南摘自藥監局官網,如有變動,以官方發布為準。