北京市藥品監督管理局關于對《北京市聚合酶鏈反應(PCR)檢驗實驗室檢查指南(2024版)》(征求意見稿)公開征集意見的公告
政策公告 北京市
為加強對PCR檢驗實驗室的監督管理,根據《醫療器械監督管理條例》(中華人民共和國國務院令第739號)、《醫療器械生產監督管理辦法》(國家市場監督管理總局令第53號)、《國家食品藥品監督管理總局關于發布醫療器械生產質量管理規范的公告》(2014年第64號)和相關配套文件等要求,以及國家和北京市發布的其他規范性文件,市藥監局組織對《聚合酶鏈反應(PCR)檢驗實驗室檢查要點指南(2016版)》進行修訂,結合我市醫療器械監管工作實際,形成《北京市聚合酶鏈反應(PCR)檢驗實驗室檢查指南(2024版)》(征求意見稿),現向社會公開征求意見,歡迎社會各界提出意見建議。
公開征集意見時間為:2024年9月24日至10月11日
意見反饋渠道如下:
1.電子郵件:qxscc@yjj.beijing.gov.cn,郵件主題請注明“PCR檢驗實驗室檢查指南反饋意見”。
2.郵寄通訊地址:北京市通州區運河東大街留莊路6號院2號樓630室,北京市藥品監督管理局醫療器械生產監管處,郵編101117。
3.電話:010-55526941
4.傳真:010-55526934
附件:1.《北京市聚合酶鏈反應(PCR)檢驗實驗室檢查指南(2024版)》(征求意見稿)
2.《北京市聚合酶鏈反應(PCR)檢驗實驗室檢查指南(2024版)》修訂說明
3.《征求意見反饋表》
北京市藥品監督管理局
2024年9月24日
附件1
北京市聚合酶鏈反應(PCR)檢驗實驗室檢查指南(2024版)(征求意見稿)
聚合酶鏈反應檢驗實驗室是指通過基因擴增的方式檢測特定的DNA或RNA的檢驗實驗室。聚合酶鏈反應(Polymerase Chain Reaction,PCR)是一種在體外特異性擴增靶DNA序列的技術,其基本過程為模板雙鏈DNA的變性、引物與模板DNA的退火和在DNA聚合酶引導下的鏈延伸反應三個階段的多次循環。每一次循環后的擴增產物均可作為下一輪循環的模板,理論上,擴增產物量呈指數形式上升,即經過n個循環后,產物量增加到2n倍。PCR試劑操作簡單,短時間內在體外可獲得數百萬個特異靶DNA序列的復制,為臨床疾病的診斷、治療監測和預后評估提供了一種極有幫助的實驗室輔助手段。
PCR檢驗實驗室是PCR試劑生產企業在產品檢驗過程中不可缺少的工作環境,其環境控制水平和質量管理水平直接影響著最終產品是否合格,能否放行。由于該產品本身的特殊性,《醫療器械生產質量管理規范附錄體外診斷試劑》、《醫療器械生產質量管理規范體外診斷試劑現場檢查指導原則》條款中,對PCR試劑的生產和檢驗環境做出明確規定。此外現行衛生行業的法規、標準以及相關文獻中對于PCR檢驗實驗室均作出規定,主要涉及《全國臨床檢驗操作規程》(第四版)、《醫療機構臨床基因擴增管理辦法》(衛辦醫政發〔2010〕194號)、《醫療機構臨床基因擴增檢驗實驗室工作導則》及《臨床診斷中聚合酶鏈反應(PCR)技術的應用》(WS/T 230-2002)等行業標準的相關要求。
本檢查指南旨在幫助北京市醫療器械監管人員增強對PCR檢驗相關過程的認知和把握,指導全市醫療器械監管人員對PCR檢驗實驗室設計建設與質量控制的監督檢查工作。同時,為PCR試劑生產企業在PCR檢驗實驗室的設計建造和管理要求提供參考。
本指南中涉及或引用的國家相關法律、法規、規章、標準、檢查指南等發生內容或效力變化時,要以當時執行的最新版為準。必要時,北京市藥品監督管理局應重新研究修訂,以確保本指南持續符合要求。
一、適用范圍
本檢查指南可作為北京市藥品監督管理局組織、實施的體外診斷試劑產品注冊質量管理體系現場核查、醫療器械生產許可現場檢查、醫療器械生產監督檢查等涉及PCR檢驗實驗室檢查的參考資料。
基因測序檢驗實驗室等涉及PCR試劑的相關部分應當參照本檢查指南執行。
二、檢查要點
(一)現場查看生產企業PCR檢驗實驗室布局
生產企業應當提供PCR檢驗實驗室設計方案和/或平面設計圖(應當標明風向或壓差梯度)。
1.PCR檢驗實驗室與PCR試劑生產區域應當在各自獨立的建筑物或空間內,保證空氣不直接連通,防止擴增時形成的氣溶膠造成交叉污染。
2.原則上PCR檢驗實驗室應當設置以下區域:試劑儲存和準備區、標本制備區、擴增區、擴增產物分析區。根據使用儀器的功能,區域可適當合并。若使用實時熒光定量PCR儀且不需要進行后續產物分析工作,擴增區、擴增產物分析區可合并。若使用樣本處理、核酸提取及擴增檢測為一體的自動化分析儀,則標本制備區、擴增區、擴增產物分析區可合并。合并的區域建議參考擴增區或擴增產物分析區要求進行條件控制。
3.各區域在物理空間上應當完全相互獨立,各區域無論是在空間上還是在使用中,應當始終處于完全的分隔狀態。不應當只是形式上的分區,不應當是一個區域嵌套一個區域。
4.各區域不應當有空氣的直接相通。擴增區與擴增產物分析區各區域宜采用獨立直排方式出風。采用空調機組方式的,PCR檢驗實驗室應當具備獨立空調機組;同時應當考慮停機后各房間空氣連通的可能性,采取必要的控制措施。
5.按照試劑儲存和準備區→標本制備區→擴增區→擴增產物分析區方向空氣壓力應當以遞減的方式進行,使得PCR檢驗實驗室的空氣流向應當按照試劑儲存和準備區→標本制備區→擴增區→擴增產物分析區方向進行,防止擴增產物順空氣氣流進入擴增前的區域。空氣流向應當為單向,禁止下游污染上游。應當設置合理的壓差梯度,并安裝壓差監測裝置,以有效證明空氣流向,壓差梯度不宜低于5帕。PCR檢驗實驗室建設可參考附件進行設計。
6.設置緩沖間的,緩沖間內通向實驗室和走廊的門應當安裝互鎖裝置或采取相應措施,避免出現兩個門同時打開的情況。
7.各區間若設置傳遞窗,應當為雙側開門,要求密封嚴實,并且兩側的門應當為互鎖裝置或采取相應措施確保兩側門不會同時開啟。同時應當考慮各區間的空氣不會通過傳遞窗互串。
(二)現場查看儀器設施配置
1.試劑儲存和準備區的功能:儲存試劑的制備、試劑的分裝和擴增反應混合液的準備,以及離心管、吸頭等消耗品的貯存和準備。配套用品一般應當包括:
(1)符合試劑儲存溫度要求的冰箱;
(2)混勻器;
(3)離心機;
(4)水浴箱或加熱模塊;
(5)微量加樣器;
(6)紫外消毒設備;
(7)消耗品:一次性手套、一次性口罩、一次性帽子、耐高壓處理和(或)一次性的離心管和加樣器吸頭;
(8)專用工作服和工作鞋(套);
(9)專用辦公用品。
2.標本制備區的功能:核酸(RNA、DNA)提取、貯存及加樣。配套用品一般應當包括:
(1)符合試劑儲存溫度要求的冰箱;
(2)高速離心機;
(3)混勻器;
(4)水浴箱或加熱模塊;
(5)微量加樣器;
(6)紫外消毒設備;
(7)生物安全柜;
(8)核酸自動提取儀;
(9)消耗品:一次性手套、一次性口罩、一次性帽子、耐高壓處理和(或)一次性的離心管和加樣器吸頭(帶濾芯);
(10)專用工作服和工作鞋(套);
(11)專用辦公用品;
(12)如需處理大分子DNA,應當具有超聲波儀。
3.擴增區的功能:cDNA合成、DNA擴增及檢測。配套用品一般應當包括:
(1)核酸擴增儀;
(2)離心機;
(3)紫外消毒設備;
(4)消耗品:一次性手套、一次性口罩、一次性帽子、耐高壓處理和(或)一次性的離心管和加樣器吸頭(帶濾芯);
(5)專用工作服和工作鞋(套);
(6)專用辦公用品。
4.擴增產物分析區的功能:擴增片段的進一步分析測定。視檢驗方法不同而定,基本配置如下:
(1)分析設備;
(2)微量加樣器;
(3)紫外消毒設備;
(4)冰箱;
(5)消耗品:一次性手套、一次性口罩、一次性帽子、加樣器吸頭(帶濾芯);
(6)專用工作服和工作鞋(套);
(7)專用辦公用品。
上述各區域儀器設備配備為基本配備,實驗室應當根據使用的擴增檢測技術或試劑的特點,對儀器設備進行必要的增減。
5.設備的維護保養
應當建立設備維護保養規程,計量設備應當定期檢定或校準。例如核酸擴增儀、微量加樣器、生物安全柜應當每年進行檢定或校準工作。
(三)現場檢查工作流程及注意事項
1.單次實驗進入各工作區域應當嚴格按照單一方向進行,即試劑儲存和準備區→標本制備區→擴增區→ 擴增產物分析區。
2.各工作區域必須有明確的標記,不同工作區域內的設備、物品不得混用。
3.不同工作區域的工作服應當加以區分,不得混用(例如可以采用不同顏色)。
4.實驗室的清潔應當按照試劑儲存和準備區→標本制備區→擴增區→擴增產物分析區的方向進行。不同的實驗區域應當有其各自的清潔用具并防止交叉污染。實驗垃圾屬于醫療廢物的應當按照《醫療廢物管理條例》相關規定進行處理。
5.工作結束后,應當立即對工作區進行清潔及消毒。
6.儲存試劑和用于標本制備的消耗品等材料應當直接運送至試劑儲存和準備區,不能經過擴增檢測區及擴增產物分析區。應當對加樣吸頭、PCR反應管等消耗品進行處理,防止污染。試劑盒中的陽性對照品和(或)質控品應當保存在標本制備區。試劑應當使用分子生物學級別試劑,溶劑不應當對產品檢驗造成干擾。質檢用于原輔料、半成品、成品檢驗用的PCR反應試劑應當有相應的質量標準及操作程序。
7.為避免樣本間的交叉污染,加入待測核酸后,應當蓋好含反應混合液的反應管。應當注意PCR反應液加樣的順序,一般應當先加陰性物質后加陽性物質。對具有潛在傳染危險性的材料,應當在生物安全柜內開蓋,并有明確的樣本處理和滅活程序。
8.應當避免氣溶膠所致的污染,盡量減少在不同區域內的走動,擴增反應管不得在擴增區打開。
9.擴增產物分析區有可能存在某些可致基因突變和有毒物質如溴化乙錠、丙烯酰胺、甲醛或放射性核素等,應當注意實驗人員的安全防護,必要時配備通風櫥等防護設備。
(四)現場檢查人員培訓情況
參與PCR檢驗的工作人員應當具備相應的專業知識和技能,包括能熟練操作相關設備,明確整個工作的流程,掌握出現污染情況的處理方法以及實驗室質量控制方法和檢測結果的解釋。
檢查人員可以通過詢問或要求人員實際操作對其進行評價,也可以通過查閱人員培訓記錄,對其進行評價。
(五)現場檢查文件情況
在檢查過程中應當特別注意現場查看、詢問、記錄的實際情況與生產企業的文件規定、記錄的符合性。
附件:1.理想的PCR檢驗實驗室設計
2.參考資料
附件
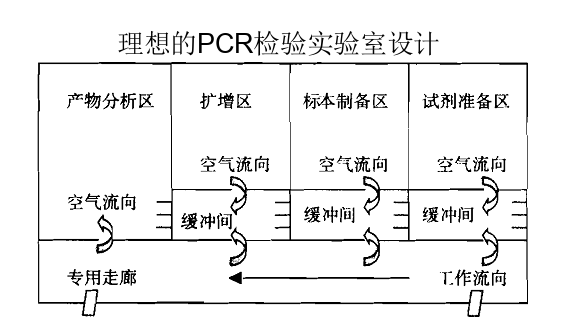
圖A 緩沖間為負壓的理想PCR檢驗實驗室設置模式
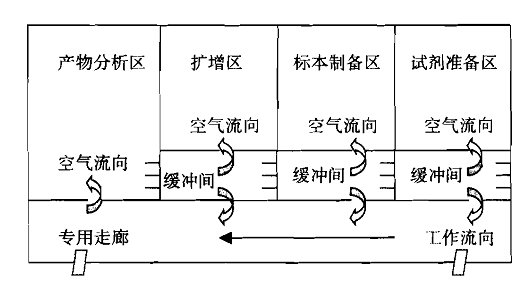
圖B 緩沖間為正壓的理想PCR檢驗實驗室設置模式
圖A和圖B所給出的PCR檢驗實驗室設置圖是較為理想的設置模式,建議企業參照此種模式設計并建立實驗室。
參考資料
1.《關于發布醫療器械生產質量管理規范的公告》(國家食品藥品監督管理總局公告2014年第64號)
2.《關于發布醫療器械生產質量管理規范附錄體外診斷試劑的公告》(國家食品藥品監督管理總局公告2015年第103號)
3.《關于印發醫療器械生產質量管理規范現場檢查指導原則等4個指導原則的通知》(食藥監械監〔2015〕218號)
4.《生物安全實驗室建筑技術規范》(GB 50346-2011)
5.《實驗室生物安全通用要求》(GB 19489-2008)
6.《臨床診斷中聚合酶鏈反應(PCR)技術的應用》(WS/T 203-2002)
7.全國臨床檢驗操作規程[第4版]
附件2
《北京市聚合酶鏈反應(PCR)檢驗實驗室檢查指南(2024版)》修訂說明
為了貫徹落實《醫療器械生產質量管理規范》及相關配套文件要求,加強北京市醫療器械生產科學監管,指導和規范北京市醫療器械生產企業監督檢查工作,幫助檢查人員增強對聚合酶鏈反應(PCR)檢驗實驗室檢查要點的認識和掌握,明確對企業聚合酶鏈反應(PCR)檢驗實驗室的基本要求,北京市藥監局結合相關法規及標準變化情況,以及北京市監管工作實際,組織對《聚合酶鏈反應(PCR)檢驗實驗室檢查要點指南(2016版)》進行了修訂。
一、修訂背景
原北京市食品藥品監督管理局組織編制了《聚合酶鏈反應(PCR)檢驗實驗室檢查要點指南(2016版)》,旨在幫助北京市醫療器械監管人員增強對PCR檢驗相關過程的認知和把握,指導全市醫療器械監管人員對PCR檢驗實驗室設計建設與質量控制的監督檢查工作。同時,為PCR試劑生產企業在PCR檢驗實驗室的設計建造和管理要求提供參考。
為進一步落實新版醫療器械生產監管法規和相關標準要求,我局于今年組織開展對《聚合酶鏈反應(PCR)檢驗實驗室檢查要點指南(2016版)》進行了修訂,結合相關法規及標準變化,以及本市醫療器械監管人員的監管實踐,進一步指導相關醫療器械生產企業做好PCR檢驗實驗室的管理工作。
二、修訂思路
結合相關法規、標準要求的變化,以及北京市PCR檢驗實驗室的監管實際,對原指南有關內容進一步修改完善,有效落實醫療器械法規、標準要求,對北京市PCR檢驗實驗室相關監管工作進行科學指導,全力提升科學監管工作水平。
三、主要修訂內容
此次修訂,主要對以下內容進行了修改和完善:
(一)法規和標準內容的更新
對原指南中已作廢或更新的法規和標準進行更新,如將《生物安全實驗室建筑技術規范》(GB 50346-2004)更新為《生物安全實驗室建筑技術規范》(GB 50346-2011),將《全國臨床檢驗操作規程》[第3版]更新為《全國臨床檢驗操作規程》[第4版]。
(二)結合監管實踐對指南內容進行完善
結合近年來醫療器械生產監管人員在對PCR實驗室監督檢查過程中的實踐經驗進行梳理和分析,并在指南中進行了完善。如對不同功能區域的儀器設施配置進行了補充和完善,將“溫度調控范圍為2℃~8℃和(或)-20℃以下冰箱”調整為“符合試劑儲存溫度要求的冰箱”,標本制備區新增了“核酸自動提取儀”,擴增區刪除“微量加樣器”等,并明確企業應當根據使用的擴增檢測技術或試劑的特點,對儀器設備進行必要的增減,以提高本指南的適用性和可操作性。
附件3
征求意見反饋表
征求意見稿名稱:
單位名稱: 填寫人: 聯系電話: | ||||
序號 | 修訂的位置(如條款序號) | 修訂的內容(原文) | 修訂的建議 | 理由或依據 |
1 | ||||
2 | ||||
3 | ||||
相關推薦
CIO提供以下相關文庫下載、合規服務以及線上培訓課程學習。























