
生產工藝變更
1.根據《藥品注冊管理辦法》,需要確定該變更是否需要到藥品監管部門備案或批準。 2.經藥品監督管理部門批準后(取得批件后),在實施變更前按照備案流程落實變更后的生產工藝。
參考價格 ¥0.00 ¥0.00
典型案例 態森德:藥品上市后變更申請



生產工藝變更服務背景介紹
生產工藝變更包括原料藥/藥品制劑的品種或數量(數量范圍)、溶劑濃度、用量的改變,生產方法的改變,批量調整、藥材炮制方法的改變等。根據《藥品注冊管理辦法》,需要確定該變更是否需要到藥品監管部門備案或批準。經藥品監督管理部門批準后(取得批件后),在實施變更前按照備案流程落實變更后的生產工藝。
由于技術進步、裝備提升、藥典及標準提高等原因,絕大多數制藥企業都會對最初批準的原工藝進行技改,這成為行業的普遍行為。雖然國家對工藝變更采取分級管理,但在實際操作過程中,由于生產工藝包括的內容多且復雜,致使企業與監管部門對變更的歸類理解存在不一致的情況。
生產工藝變更服務流程
變更原料藥生產工藝:
1、開展相關研究工作
2、評估變更類別
3、準備申報資料
4、在國家藥監局藥審中心原輔包平臺登記
5、根據需要進行檢驗或技術審評
6、網站公示備案結果
變更藥品制劑生產工藝:
1、開展相關研究工作
2、評估變更類別
3、準備申報資料
(1)藥品綜述資料
(2)藥品批準證明文件及其附件的復印件
(3)藥品研究資料
(4)修訂前后藥品說明書及標簽樣稿
4、向省級藥品監管部門備案
5、根據需要進行檢驗或技術審評
6、上報國家局網站公示備案結果
生產工藝變更我們的服務
1、評估變更對藥品安全性、有效性和質量可控性的影響
2、變更后的生產工藝試驗與驗證
3、輔導研究資料及申報材料編寫
4、和藥監部門溝通
5、全程跟蹤備案進度
生產工藝變更交付樣本

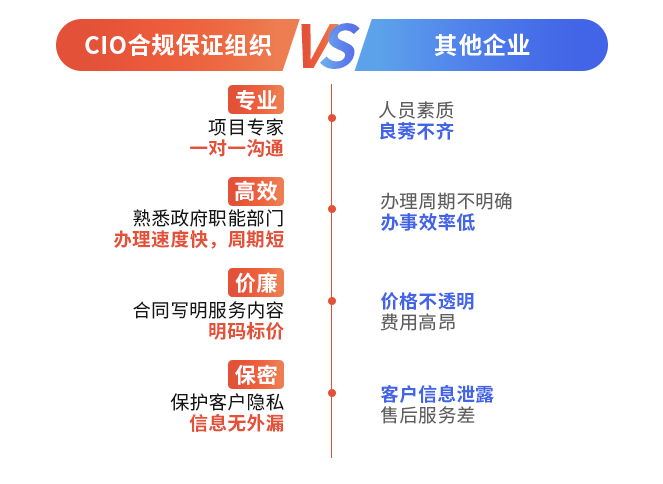
生產工藝變更我們的優勢
分享










