
仿制藥上市許可申請
1.為醫藥產品申請在國內上市提供注冊咨詢服務。 2.幫助客戶順利獲取《藥物臨床試驗通知》、《藥品注冊證書》、《藥品再注冊批準通知書》或《藥品補充申請批準通知書》。
參考價格 ¥0.00 ¥0.00
典型案例 延安藥業:仿制藥一致性評價



仿制藥注冊
化學仿制藥包括注冊分類3類和4類的產品。3類與4類的區別主要看原研產品是否在中國境內上市。即使中國境內已經有仿制藥上市多年,只要原研產品從未在中國上市,注冊分類就是3類。
仿制藥上市許可申請服務范圍
CIO提供國內、國外生產化學仿制藥的臨床試驗申請或豁免(如有)、BE試驗登記(如有)、上市許可申請、藥品上市后變更及再注冊申請等服務。
仿制藥上市許可申請服務內容
1.為境外藥品注冊申請提供注冊代理服務。
2.藥品注冊資料差距分析、風險評估,并指導客戶進行補充完善。
3.負責外文注冊資料的專業翻譯、校對。
4.CTD格式注冊申請資料編寫、審核及遞交。
5.eCTD格式出版與提交。
6.全程跟蹤CDE審評進度,積極與審評員溝通、回復專家提問。
7.指導CDE技術審評過程中補充資料內容回復及資料遞交。
8.注冊檢驗申請、送樣、跟蹤及問題解決。
9.如有需要,可協助GMP部門為現場核查提供服務。
10.已上市藥品的變更維護,包括審批類變更、備案及年報。
11.已上市藥品再注冊申請。
仿制藥注冊收費標準
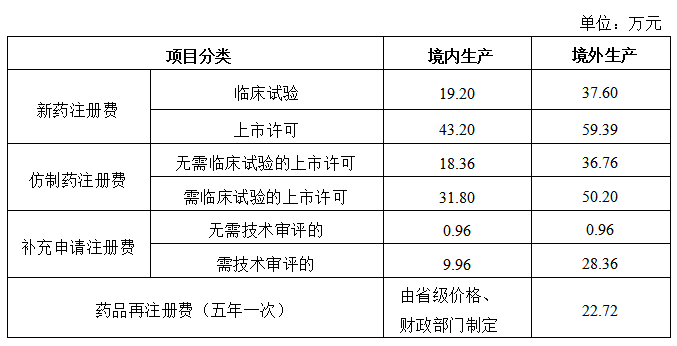
注:《藥品注冊收費標準》與《藥品注冊收費實施細則》自2020年7月1日起施行。
分享










